Współczesna wysokosprawna chromatografia cieczowa (HPLC) to technika, która zrewolucjonizowała analitykę chemiczną, farmaceutyczną i kliniczną. Choć sercem układu chromatograficznego jest kolumna, w której zachodzi proces rozdziału, to detektor pełni rolę oczu układu. Bez precyzyjnej i powtarzalnej detekcji, wysiłek włożony w optymalizację fazy ruchomej i stacjonarnej pozostałby niedostrzeżony.

Istota detekcji: Przetwarzanie sygnału
Rola detektora w HPLC wykracza poza proste „wykrywanie” obecności substancji. Jego zadaniem jest ciągłe monitorowanie składu eluatu opuszczającego kolumnę i przekształcanie zmiennej fizykochemicznej (np. absorbancji, fluorescencji, przewodnictwa) na sygnał elektryczny (napięcie).
Sygnał ten, po wzmocnieniu i przetworzeniu przez przetwornik analogowo-cyfrowy, tworzy chromatogram. Kluczowe parametry charakteryzujące pracę detektora to:
- Czułość: Zdolność do wykrywania małych zmian stężenia.
- Granica wykrywalności (LOD): Najniższe stężenie analitu dające sygnał wyraźnie odróżnialny od szumu tła (zwykle stosunek sygnału do szumu S/N > 3).
- Zakres liniowości: Zakres stężeń, w którym sygnał jest wprost proporcjonalny do ilości substancji.
- Selektywność: Zdolność detektora do reagowania wyłącznie na wybrane grupy związków.
Co ważne, detektory w HPLC muszą pracować w warunkach ciągłych i być przystosowane do przepływu. W przypadku tych partych o techniki spektroskopowe, eluat z kolumny wpływa do tzw. Celi. Jest to swego rodzaju przepływowa kuweta, która umożliwia analizę spektralną.
Część detektorów niszczy próbki bezpowrotnie (np. detektor CAD, czy detektory masowe).
Detektory stosowane w HPLC
Wybór detektora zależy od struktury chemicznej analitu oraz wymaganej czułości. Poniżej przedstawiamy szczegółową analizę najpopularniejszych i specjalistycznych rozwiązań.
Detektory Spektrofotometryczne (UV-Vis oraz DAD)
To najpowszechniej stosowana grupa detektorów, wykorzystująca zjawisko absorpcji promieniowania elektromagnetycznego przez chromofory w cząsteczce analitu (zgodnie z prawem Lamberta-Beera).
- Klasyczny UV-Vis: Monitoruje absorbancję przy jednej lub kilku wybranych długościach fali.
- DAD (Diode Array Detector): Wykorzystuje matrycę diodową, co pozwala na rejestrację pełnego widma UV-Vis w czasie rzeczywistym dla każdego piku. Umożliwia to badanie czystości piku oraz identyfikację substancji na podstawie bibliotek widm.
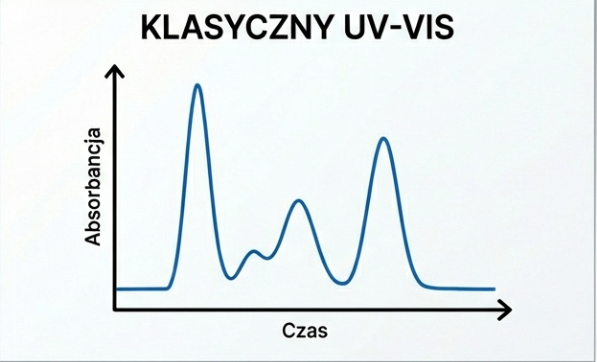
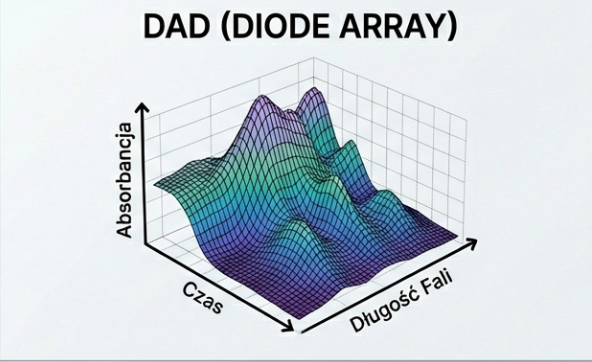
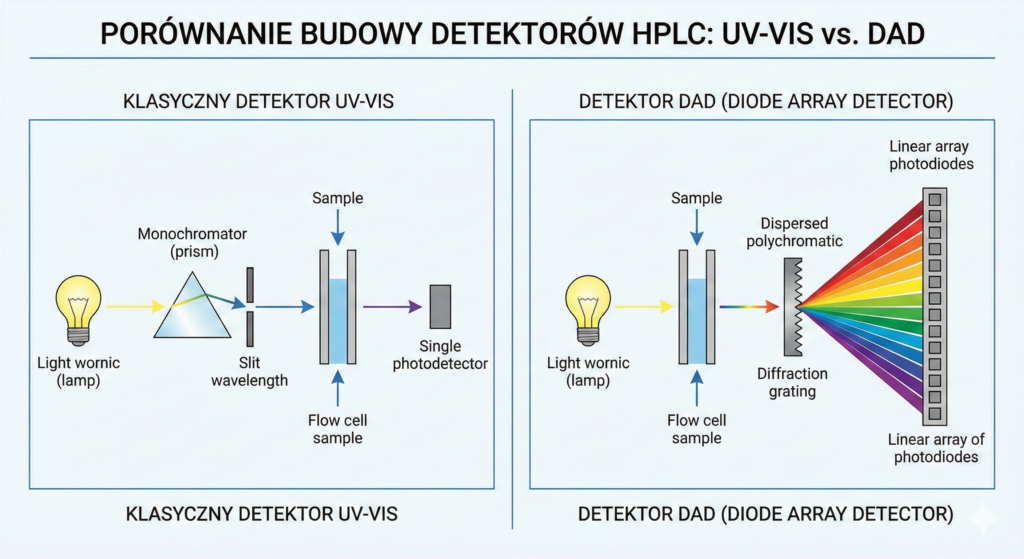
Zalety: Wysoka czułość dla wielu związków organicznych, dobra liniowość, kompatybilność z elucją gradientową, nieniszczący charakter detekcji.
Wady: Wymaga obecności chromoforów (wiązania podwójne, pierścienie aromatyczne); rozpuszczalniki fazy ruchomej muszą mieć niską absorbancję własną (tzw. UV cut-off).
Detektor Fluorescencyjny (FLD)
Detekcja oparta na zjawisku emisji światła przez cząsteczkę po jej uprzednim wzbudzeniu. Jest znacznie bardziej czuła niż UV-Vis.
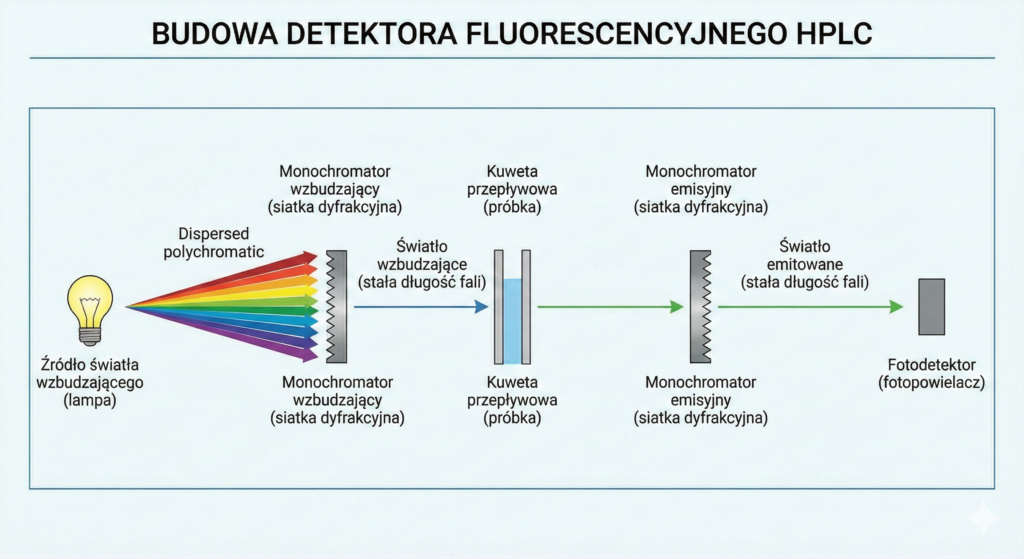
Zalety: Ekstremalnie niska granica wykrywalności (nawet o 2-3 rzędy wielkości lepsza niż UV), wysoka selektywność (tylko nieliczne związki naturalnie fluoryzują).
Wady: Ograniczona liczba związków wykazujących fluorescencję naturalną (często wymagana derywatyzacja); wrażliwość na wygaszanie fluorescencji (quenching) przez składniki matrycy.
Detektor Refraktometryczny (RID)
Detektor uniwersalny, reagujący na różnicę współczynnika załamania światła między czystą fazą ruchomą a eluatem zawierającym analit.
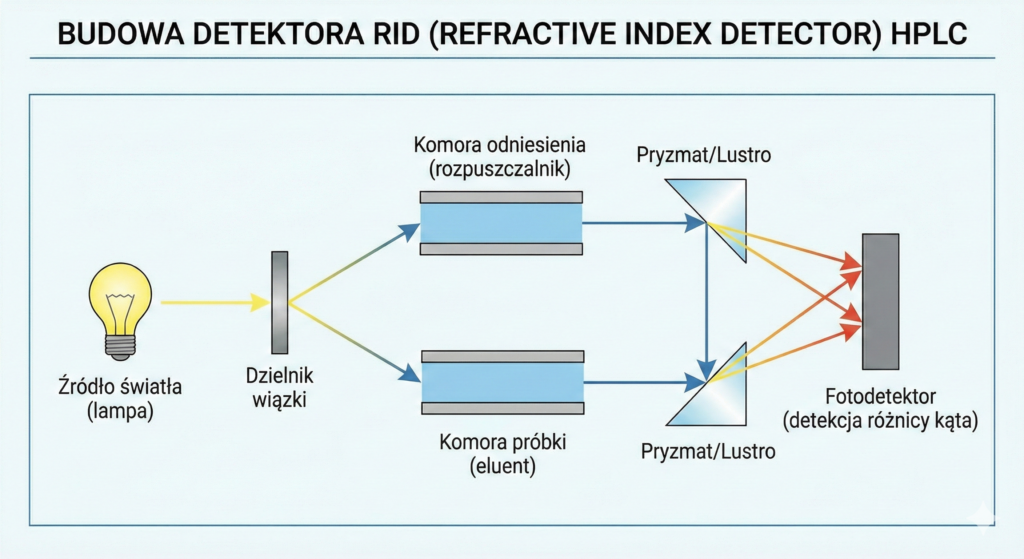
Zalety: Reaguje na niemal wszystkie substancje (cukry, polimery, lipidy); niezastąpiony, gdy analit nie posiada chromoforów.
Wady: Niska czułość, ekstremalna wrażliwość na zmiany temperatury i ciśnienia, brak możliwości stosowania elucji gradientowej.
Detektory rozproszeniowe: ELSD i MALS
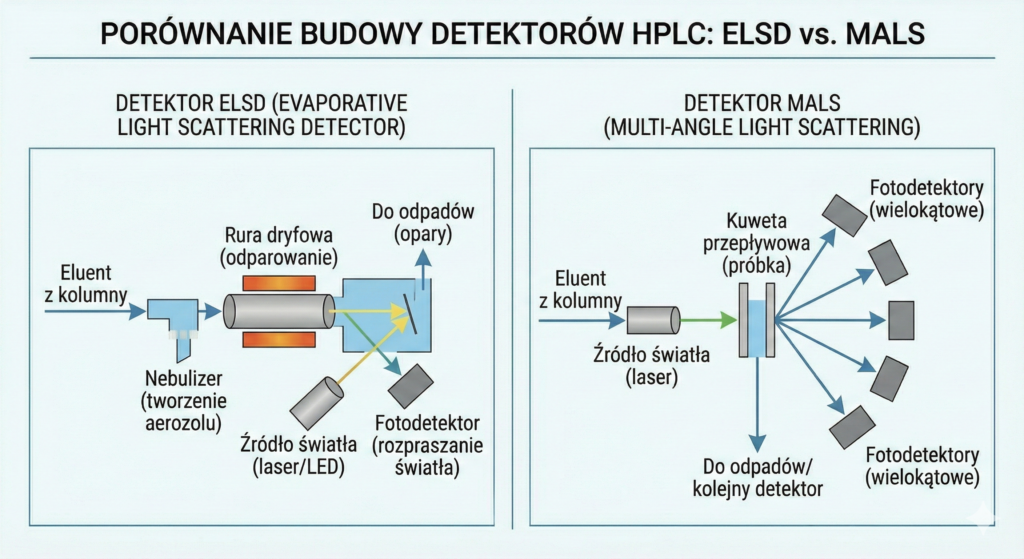
ELSD
ELSD (Evaporative Light Scattering Detector) to urządzenie, w którym eluat jest rozpylany, rozpuszczalnik odparowywany, a pozostałe nielotne cząstki analitu przechodzą przez wiązkę światła, powodując jego rozproszenie. Detektor analizuje rozproszenie światła (Light scattering), które jest wprost proporcjonalne do stężenia analitu.
Zalety: Detektor „uniwersalny” dla substancji nielotnych; kompatybilny z gradientem; sygnał nie zależy od obecności chromoforów.
Wady: Niszczy próbkę; wymaga gazu nośnego (azot); nieliniowa odpowiedź detektora w szerokim zakresie stężeń.
MALS
MALS (Mulit-Angle Light Scattering)W przeciwieństwie do prostych detektorów rozproszeniowych typu ELSD, które służą głównie do kwantyfikacji, MALS mierzy natężenie światła rozproszonego przez próbkę pod wieloma kątami jednocześnie. Dzięki wykorzystaniu zależności opisanych równaniem Rayleigha, detektor ten pozwala na wyznaczenie bezwzględnej masy cząsteczkowej oraz średniego kwadratowego promienia rotacji (tzw. promienia bezwładności, Rg) bez konieczności posiadania wzorców kalibracyjnych o znanej masie.
Jest to narzędzie nieocenione w biofarmacji i chemii polimerów, szczególnie przy badaniu:
- Agregacji białek: Pozwala precyzyjnie odróżnić monomery od dimerów i większych oligomerów.
- Architektury polimerów: Umożliwia określenie stopnia rozgałęzienia łańcuchów.
- Czystości biocząsteczek: Działa jako niezwykle czuły sensor obecności zanieczyszczeń o wysokiej masie cząsteczkowej.
Z punktu widzenia konfiguracji sprzętowej, MALS niemal zawsze występuje w układzie z innym detektorem stężeniowym (np. RID lub UV), co tworzy potężną platformę analityczną do pełnej charakterystyki fizykochemicznej badanego materiału. Detektor MALS jest często stosowany w chromatografii wykluczenia mas (SEC-MALS). Dzięki temu gromadzi się cenne informacje na temat charakteru i budowy agregatów czy innych zanieczyszczeń.
Zalety: Bezględny pomiar masy cząsteczkowej, Wyznaczenie promienia bezwładności, Analiza kształtu i konformacji, Esktremalna czułość na agregaty
Wady: Konieczność znajomości parametru dn/dc, wymóg współpracy z drugim detektorem, wrażliwość na czystość układu (szum optyczny), wysoki koszt, nie nadaje się dla cząstek <10 kDa.
Detektor Wyładowań Koronowych i CAD (Charged Aerosol Detector)
CAD to zaawansowana technologia, w której analit po odparowaniu rozpuszczalnika jest ładowany elektrycznie przez kontakt ze zjonizowanym strumieniem azotu. Prąd przenoszony przez cząstki jest mierzony przez czuły elektrometr.
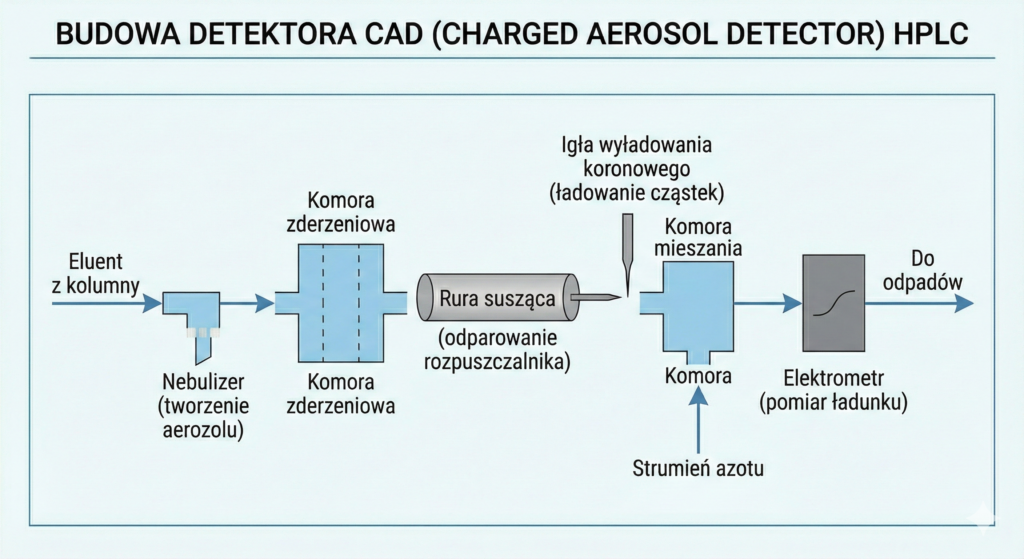
Zalety: Wyższa czułość i lepsza liniowość niż w ELSD; doskonały do analizy lipidów, surfaktantów i jonów.
Wady: Niszczy próbkę; wymaga lotnych faz ruchomych (podobnie jak MS).
Detektory Elektrochemiczne: Konduktometryczny, Potencjometryczny i PAD
- Konduktometryczny: Mierzy przewodnictwo elektryczne. Standard w chromatografii jonowej (IC).
- Potencjometryczny: Mierzy różnicę potencjałów między elektrodami.
- PAD (Pulsed Amperometric Detection): Wykorzystuje utlenianie lub redukcję analitu na powierzchni elektrody roboczej.
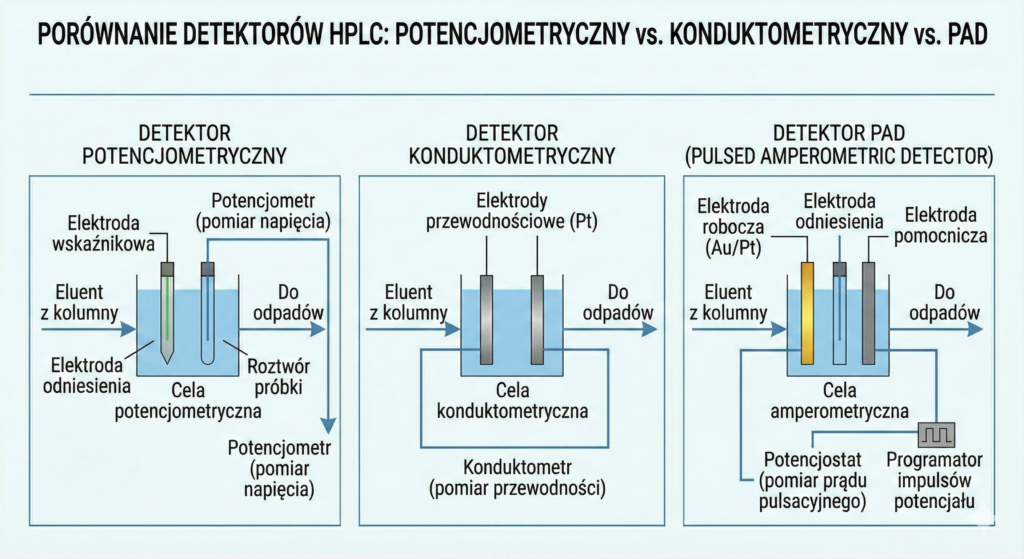
Zalety: Wyjątkowa czułość dla jonów (konduktometria) oraz cukrów i aminokwasów (PAD).
Wady: Wymaga przewodzącej fazy ruchomej; konieczność częstej konserwacji elektrod.
Spektrometria Mas (MS) jako detektor
Jest to obecnie najbardziej zaawansowane narzędzie w HPLC. Analit wchodzący do spektrometru mas ulega jonizacji. W analizatorach jonow, cząteczki są od siebie oddzielane na podstawie stosunku ich masy do ładunku (m/z). Współczesne spektrometry mas łączą ze sobą wiele analizatorów, co umożliwia dodatkowo fragmentowanie jonow i dokładną analizę struktury cząsteczki.
Zalety: Najwyższa selektywność i czułość; możliwość identyfikacji strukturalnej; pozwala na analizę śladową w bardzo złożonych matrycach.
Wady: Bardzo wysoki koszt zakupu i eksploatacji; wymaga wysokich kompetencji operatora; konieczność stosowania wyłącznie lotnych buforów.
Uwaga! Marzec będzie poświęcony właśnie spektrometrii mas. Chcesz dowiedzieć się więcej na jej temat? Zapisz się do newslettera by nic nie przegapić.
Kryteria wyboru detektora
Dobór detektora musi być podyktowany właściwościami fizykochemicznymi badanych cząsteczek. Poniżej przedstawiamy algorytm decyzyjny:
- Czy cząsteczka posiada chromofory (np. wiązania podwójne, pierścienie aromatyczne)?
- tak -> Wybierz detektor UV-VIS
- Czy cząsteczka jest jonem lub posiada ładunek?
- Tak -> Wybierz Detektor konduktometryczny (chromatografia jonowa).
- Czy cząsteczka jest cukrem lub alkoholem wielowodorotlenowym?
- Wybierz RID (dla prostych analiz izokratycznych) lub PAD/CAD (dla wysokiej czułości i gradientu).
- Czy wymagana jest analiza śladowa w złożonej matrycy (np. krew, ścieki)?
- Wybierz FLD (jeśli fluoryzuje) lub MS.
- Czy badasz polimery lub lipidy bez chromoforów w gradiencie?

Analiza porównawcza – zestawienie technologii
Poniższa tabela stanowi szybkie źródło referencyjne dla chemika analityka przy projektowaniu nowej metody.
| Detektor | Zastosowanie | Główna zaleta | Główna wada |
| UV-Vis / DAD | Związki organiczne, leki, witaminy | Wysoka odporność, łatwa obsługa | Niska czułość dla związków alifatycznych |
| FLD | Aflatoksyny, WWA, derywatyzowane aminokwasy | Ekstremalna czułość i selektywność | Mała uniwersalność (wymaga fluorescencji) |
| RID | Cukry, polimery (izokratycznie) | Uniwersalność (widzi wszystko) | Brak możliwości pracy w gradiencie |
| ELSD / CAD | Lipidy, kwasy tłuszczowe, surfaktanty | Praca w gradiencie dla braku chromoforów | Niszczy próbkę, wymaga gazu |
| MALS | Białka, polisacharydy, polimery syntetyczne | Wyznaczanie bezwzględnej masy cząsteczkowej bez wzorców | Wysoka cena, wymaga bardzo czystych rozpuszczalników |
| MS | Proteomika, metabolomika, ślady pestycydów | Jednoznaczna identyfikacja (masa) | Wysoka cena i skomplikowana obsługa |
| PAD | Węglowodany, glikozydy | Bardzo niska granica wykrywalności | Wymaga specyficznych faz ruchomych (pH) |
| Konduktometria | Aniony i kationy nieorganiczne | Standard w analizie wody i ścieków | Ograniczona tylko do związków jonowych |
Przy wyborze detektora warto też rozważyć kwestię niszczenia próbki. Detektory spektroskopowe czy alektrochemiczne nie niszczą próbki. Umożliwia to łączenie tandemowo kilku detektorów i analizę próbki pod różnym kątem. Typowym przykładem jest analiza LC-MS, w której próbka przechodzi najpierw przez detektor UV-VIS by następnie wlecieć do detektora masowego. Umożlwia to identyfikację poszczególnych pików czy określenie ich struktury. Można również stosować rozdzielniki typu T by część eluatu kierować do jednego detektora a część do drugiego.
Podsumowanie i wnioski końcowe
Wybór detektora w HPLC to balansowanie między uniwersalnością a specyficznością. Podczas gdy detektory takie jak RID czy CAD pozwalają „zobaczyć wszystko”, to detektory specyficzne, jak FLD czy MS, oferują niezrównaną czułość, pozwalającą wyłuskać śladowe ilości analitu z szumu tła matrycy biologicznej czy środowiskowej.
W dobie nowoczesnych laboratoriów, trendem jest stosowanie detekcji sprzężonej (np. DAD-MS lub DAD-FLD), co pozwala na uzyskanie maksymalnej ilości informacji o próbce podczas jednego nastrzyku. Pamiętajmy, że detektor jest tak dobry, jak jego kalibracja i zrozumienie przez analityka procesów fizycznych zachodzących w celi pomiarowej.
Literatura źródłowa i bibliografia
I. Literatura książkowa (Monografie i podręczniki akademickie)
- Witkiewicz Z., Kałużna-Czaplińska J., Podstawy chromatografii, Wydawnictwo Naukowo-Techniczne (WNT), Warszawa 2010.
- Snyder L.R., Kirkland J.J., Dolan J.W., Introduction to Modern Liquid Chromatography, 3rd Edition, John Wiley & Sons, 2009.
- https://scioninstruments.com/blog/the-different-types-of-hplc-detectors/
- agilent.com
- waters.com
- thermofisher.com
- chromatographyonline.com




