Spektrofotometria UV-VIS to jedna z fundamentalnych technik analitycznych, która znajduje szerokie zastosowanie w naukach przyrodniczych, chemii i medycynie. Pozwala na jakościową i ilościową analizę substancji poprzez pomiar pochłaniania (absorpcji) promieniowania w zakresie ultrafioletu (UV) i światła widzialnego (VIS). Spektrofotometria UV-VIS może funkcjonować jako samodzielne narzędzie lub jako sposób detekcji w innych technikach analitycznych takich jak HPLC czy ELISA.
Dlaczego cząsteczki pochłaniają światło UV?
Cząsteczki posiadają zdolność do pochłaniania promieni UV. Dzieje się tak dzięki elektronom krążącym wokół jądra atomu. Elektrony krążą wokół jąder atomów po tzw. orbitalach, które są związane ze stanem energetycznym. Stały orbital elektronu to tzw. Stan spoczynkowy. Gdy elektron wchłonie kwant energii (np. świetlnej) przechodzi na wyższy orbital (stan wzbudzony). Stan wzbudzony jest zazwyczaj niestabilny. Elektron szybko wraca więc do stanu spoczynkowego. Podczas przejścia do stanu spoczynkowego emituje energię w postaci ciepła lub światła (fluorescencja). Przejście ze stanu spoczynkowego do wzbudzonego nazywamy przejściem elektronowym.
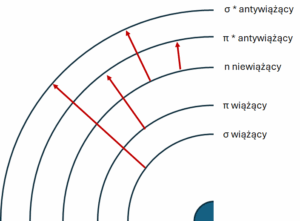
Rodzaje przejść elektronowych
W strukturze atomu możemy wyróżnić pięć rodzajów orbitali
- Orbitale wiążące σ i π
- Orbitale niewiążące n
- Orbitale antywiążące σ* i π*
Absorpcja promieniowania UV-VIS przez cząsteczki prowadzi do wzbudzenia elektronów z niższych na wyższe poziomy energetyczne. Rodzaj przejścia elektronowego zależy od struktury chemicznej badanej substancji. Wyróżniamy kilka podstawowych typów przejść:
- Przejścia σ → σ*: Występują w związkach nasyconych, które posiadają jedynie wiązania pojedyncze (σ). Przejścia te wymagają dużej energii, dlatego zachodzą w dalekim ultrafiolecie (poniżej 200 nm).
- Przejścia n → σ*: Charakterystyczne dla związków nasyconych zawierających atomy z wolnymi parami elektronowymi (n), np. alkohole, etery, aminy. Wymagają mniejszej energii niż przejścia σ → σ*.
- Przejścia π → π*: Obserwowane w związkach nienasyconych, które posiadają wiązania podwójne lub potrójne (π), np. alkeny, alkiny, związki aromatyczne. Przejścia te są odpowiedzialne za intensywne pasma absorpcji.
- Przejścia n → π*: Występują w związkach nienasyconych z heteroatomami posiadającymi wolne pary elektronowe, np. ketony, aldehydy. Wymagają najmniejszej energii i są odpowiedzialne za pasma absorpcji w zakresie bliskiego UV i widzialnego.
Prawa absorpcji
Podstawą spektrofotometrii UV-VIS jest pomiar intensywności światła przechodzącego przez próbkę. Jeżeli próbka absorbuje światło intensywność dochodząca do detektora jest niższa.
)
Miarą ilości pochłoniętego światła jest absorbancja, którą wyznacza się z następującego wzoru. Podstawą obliczeń jest prawo Lamberta-Beera, które opisuje zależność między absorpcją promieniowania a stężeniem substancji. Prawo to można wyrazić wzorem:
A = ε * c * l
gdzie:
- A – absorbancja (bezwymiarowa)
- ε – molowy współczynnik absorpcji (L·mol⁻¹·cm⁻¹) – stała charakterystyczna dla danej substancji przy określonej długości fali. Współczynnik ten nazywa się współczynnikem ekstynkcji
- c – stężenie molowe substancji (mol·L⁻¹)
- l – grubość warstwy absorbującej
Zgodnie z tym prawem, absorbancja jest wprost proporcjonalna do stężenia substancji i grubości warstwy roztworu. W spektrofotometrach kuwetowych grubość warsty roztworu określona jest szerokością kuwety

Budowa spektrofotometru UV-VIS
Typowy spektrofotometr UV-VIS składa się z następujących elementów:
- Źródło promieniowania:
- Lampa deuterowa: emituje promieniowanie w zakresie UV (190-380 nm).
- Lampa wolframowa lub wolframowo-halogenowa: emituje promieniowanie w zakresie VIS (380-900 nm).
- Monochromator: Służy do wyboru określonej długości fali z szerokiego spektrum emitowanego przez lampę. Najczęściej stosuje się siatki dyfrakcyjne.
- Kuweta: Naczynie, w którym umieszcza się próbkę do analizy. Kuwety wykonane są z materiałów przepuszczających promieniowanie w danym zakresie (szkło dla VIS, kwarc dla UV). Kuwety najczęściej wykonane są z polimeru lub kwarcu. Ich ściany, przez które przechodzi promień światła są przezroczyste.
- Detektor: Mierzy natężenie promieniowania przechodzącego przez próbkę. Najczęściej stosowanymi detektorami są fotodiody i fotopowielacze.
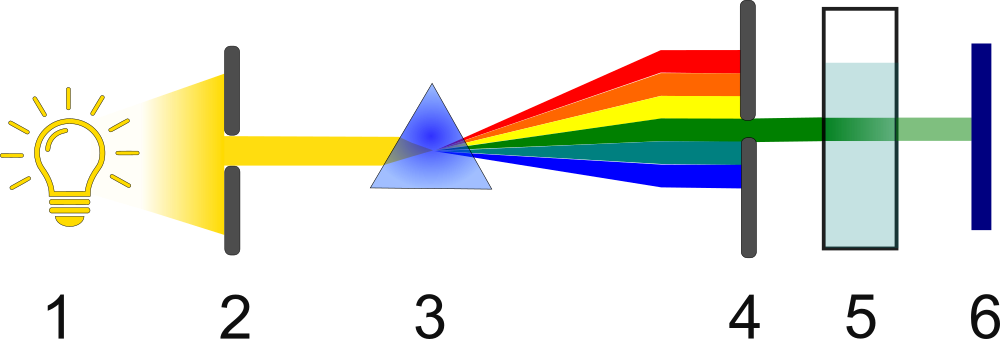
- Źródło światła
- Przesłona
- Pryzmat
- Monochromator
- Kuweta z próbką
- Detektor

Czytniki płytek wielodołkowych

Innym typem spektrofotemtru UV-VIS są czytniki płytek wielodołkowych. W przeciwieństwie do spektrofotometrów kuwetowych, w tym przypadku światło przechodzi przez dno płytki a detektor znajduje się nad płytką. Z tego powodu ścieżka zależy ściśle od objętości roztworu w płytce a pomiar obarczony jest błędem związanym z pipetowaniem. Niemniej jednak, zastososowanie nowoczesnych pipet, ich regularna kalibracja i możliwość szybkiego pomiaru wielu próbek powoduje, że ten jest bardzo popularny.
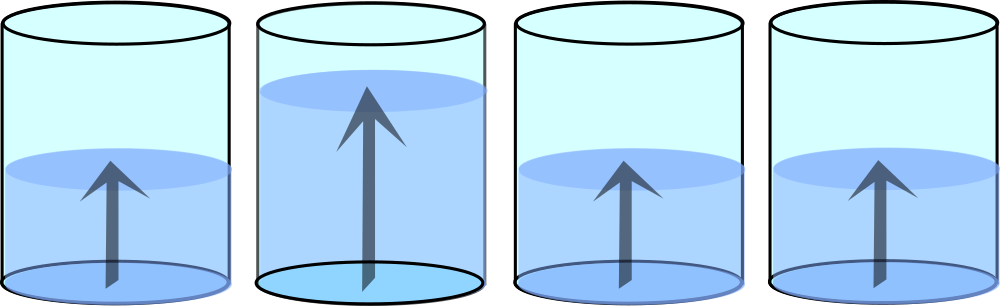
Analiza ilościowa
Analiza ilościowa w spektrofotometrii UV-VIS polega na wyznaczeniu stężenia nieznanej próbki na podstawie pomiaru jej absorbancji. Najczęściej stosowaną metodą jest metoda krzywej wzorcowej. Polega ona na przygotowaniu serii roztworów wzorcowych o znanych stężeniach, zmierzeniu ich absorbancji i wykreśleniu zależności absorbancji od stężenia. Następnie mierzy się absorbancję próbki o nieznanym stężeniu i odczytuje jej stężenie z krzywej wzorcowej.
Zastosowanie w analizie ilościowej
Spektrofotometria UV-VIS jest szeroko stosowana w analizie ilościowej w różnych dziedzinach:
- Biochemia: oznaczanie stężenia białek, kwasów nukleinowych, enzymów.
- Farmacja: kontrola jakości leków, oznaczanie zawartości substancji czynnych.
- Ochrona środowiska: oznaczanie stężenia zanieczyszczeń w wodzie i glebie (np. fenoli, metali ciężkich).
- Przemysł spożywczy: kontrola jakości produktów, oznaczanie zawartości barwników, konserwantów.
- Diagnostyka medyczna: oznaczanie stężenia bilirubiny, glukozy, hemoglobiny we krwi.
Analiza jakościowa
Widmo UV-VIS jest może być charakterystyczne dla danej cząsteczki. Wykonując pomiar w pewnym zakresie fal otrzymuje się widmo, które odzwierciedla obecność niektórych wiązań chemicznych i skład cząsteczki. Dobrym przykładem jest różnica w widmie UV-VIS dla hemoglobiny i methemoglobiny. Methemoglobina jest efektem nieodwracalnego wiązania się hemoglobiny z tlenkiem węgla (zaczadzenie). Występuje w niej charakterystyczne maximum absorpcji przy długości fali 560 nm i dużo niższa absorbancja przy długości fali 450 nm.
Zastosowanie w analizie jakościowej
Spektrofotometria UV-VIS może być również wykorzystywana do identyfikacji substancji. Każda substancja ma charakterystyczne widmo absorpcji, czyli wykres zależności absorbancji od długości fali. Porównując widmo nieznanej próbki z widmami wzorcowymi, można ją zidentyfikować. Ponadto, analiza widma pozwala na:
- Określenie czystości substancji: Obecność zanieczyszczeń może powodować pojawienie się dodatkowych pasm absorpcji.
- Badanie struktury cząsteczek: Położenie i intensywność pasm absorpcji dostarczają informacji o obecności określonych grup funkcyjnych i układów wiązań.
Spektrofotometria UV-VIS jako metoda detekcji w innych technikach
Detektory UV-VIS znalazły szerokie zastosowanie w różnych technikach analitycznych. Są najczęściej wykorzystywanym detektorem w wysokosprawnej chromatografii cieczowej. Służą do monitorowania hodowli komórkowej (pomiar OD). Wykorzystuje się je w testach kolorymetrycznych, testach komórkowych, biochemicznych, testach ELISA. Jest to możliwe, dzięki uniwersalności, prostej budowie, niskiemu kosztowi i szybkości pomiaru.
Źródła książkowe
- Kęcki, Zbigniew. Spektroskopia molekularna. Wydawnictwo Naukowe PWN, 2013, ISBN 978-83-01-10503-7
- Szczepaniak, Walenty. Metody instrumentalne w analizie chemicznej. Wydawnictwo Naukowe PWN, 2008, ISBN 978-83-01-14210-0
Źródła internetowe
- https://www.mt.com/pl/pl/home/library/guides/lab-analytical-instruments/uvvis-spectrophotometry-guide-applications-fundamentals.html
- https://derangedphysiology.com/main/cicm-primary-exam/respiratory-system/Chapter-126/spectrophotometry-carboxyhaemoglobin
- Wikipedia – Wolna Encyklopedia: .
Ilustracje
