W projektowaniu jakości niezwykle istotnym elementem jest identyfikacja krytycznych właściwości i zmiennych. Dzięki temu w trakcie opracowania procesu możemy się skupić na optymalizacji najbardziej kluczowych etapów. Z tego powodu jednym z najważniejszych elementów rozwoju produktu i procesu jest identyfikacja krytycznych cech jakościowych. Każdy produkt ma jakieś cechy. Niektóre będą związane z wydajnością (np. wydajnością produkcji), inne będą bezpośrednio wpływać na jakość (efektywność, bezpieczeństwo, stabilność). Te drugie nazywamy krytycznymi cechami jakościowymi. By produkt był skuteczny i bezpieczny, muszą być kontrolowane i utrzymane w odpowiednim zakresie lub poniżej/powyżej określonego limitu.

To drugi wpis poświęcony zagadnieniom związanym z projektowaniem jakości w rozwoju leków. Dowiecie się z niego co to są krytyczne cechy jakościowe, jak określić czy jakaś cecha jest krytyczna i co zrobić skoro już o tym wiemy.
Co to są krytyczne cechy jakościowe?
Według wytycznych ICH Q9 krytyczna cecha jakościowa (CQA) to każda cecha fizykochemiczna i biologiczna lub mikrobiologiczna, która powinna być w określonym limicie, zakresie lub dystrybucji by zapewnić odpowiednią jakość produktu. Pod pojęciem jakości musimy mieć przede wszystkim na uwadze fakt, że każdy produkt leczniczy powinien po pierwsze leczyć, po drugie być bezpieczny dla pacjenta.
Krytyczne cechy jakościowe są związane z różnymi elementami produktu: substancją aktywną, składnikami formulacji, surowcami czy opakowaniem.
Poniżej znajdziecie przykłady krytycznych cech jakościowych związanych z różnymi formami leków
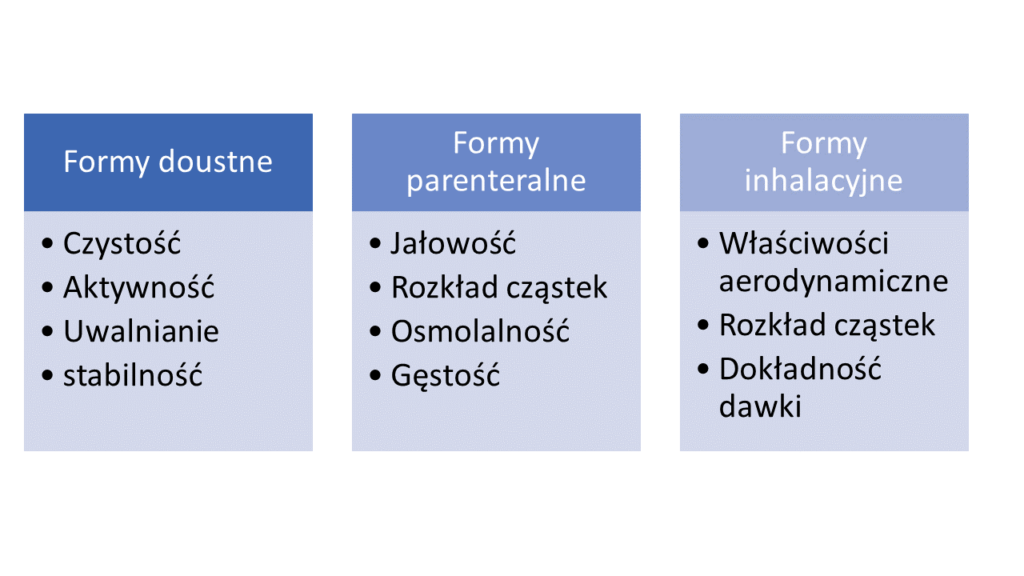
Krytyczne cechy jakościowe a QTPP
Identyfikacja krytycznych cech jakościowych jest kluczowa do stworzenia QTPP. QTPP to docelowy jakościowy profil produktu. Jest to nic innego jak zbiór wymagań jakościowych, które powinien spełniać docelowo produkt leczniczy. Dokument ten jest wskazówką dla naukowców i inżynierów rozwijających proces produkcyjny a dla analityków punktem wyjścia do opracowania metod analitycznych.
Zarówno lista krytycznych cech jakościowych jak i QTPP są elementami, które zmieniają się w czasie. W miarę jak zdobywamy nową wiedzę na temat produktu i procesu możemy ją wykorzystać do ponownej oceny krytyczności i rewizji QTPP. Oznacza to, że ocenę krytyczności cech jakościowych wykonujemy kilkukrotnie, na różnych etapach rozwoju produktu.
Jak ocenić czy cecha jest krytyczna?
W ocenie krytyczności cech z pomocą przychodzą narzędzia analizy ryzyka. W poszukiwaniu odpowiednich narzędzi pomocny może być ICH Q9. Opisanych jest tam kilka technik, które można zastosować. Dla potrzeb oceny cech jakościowych idealnie sprawdzi się technika PHA (Preliminary Hazard Analysis) – Wstępna analiza ryzyka. Jest to metoda półilościowa, dzięki której możemy przypisać cechom ryzyko na np. trzech poziomach: niskie, średnie, wysokie.

Utwórz zespół roboczy
Każda analiza ryzyka rozpoczyna się od utworzenia zespołu. Zespół prowadzący analizę powinien być jak najbardziej różnorodny, żeby w trakcie analizy móc spojrzeć na problem z różnych stron. Dobrze więc jeśli w zespole znajdą się:
- Specjaliści od rozwoju procesu i formulacji
- Specjaliści od analityki
- Specjaliści z dziedziny bezpieczeństwa
- Farmakolodzy
- Statystycy
Sformułuj problem
Po zebraniu zespołu i wybraniu osoby odpowiedzialnej za moderację analizy istotne jest odpowiednie sformułowanie problemu i przyjęcie pewnych założeń umożliwiających późniejszą klasyfikację. Zacznijmy od sformułowania problemu.
W analizie krytyczności celem jest sprawdzenie możliwości wpływu cechy na skuteczność leku i jego bezpieczeństwo. Można to zrobić na poziomie bardzo ogólnym np. wpływ na skuteczność i wpływ na bezpieczeństwo lub rozbić te aspekty na składowe. Przykładowe oceniane aspekty to:
- Aktywność
- Farmakokinetyka/Farmakodynamika
- Immunogenność
- Efekty uboczne
Wybierz sposób oceny ryzyka
Ostatnią rzeczą przed rozpoczęciem prac jest wybranie sposobu liczenia ryzyka. Osobiście polecam wykonać analizę krytyczności oboma sposobami, gdyż uzyskane wyniki mogą się od siebie różnić. Czym zatem różnią się oba podejścia. Przedstawia to poniższy rysunek. W obu przypadkach ryzyko liczone jest jako iloczyn dwóch składowych opisanych na osiach wykresów. W pierwszym podejściu będzie to niepewność i wpływ, w drugim prawdopodobieństwo i dotkliwość.
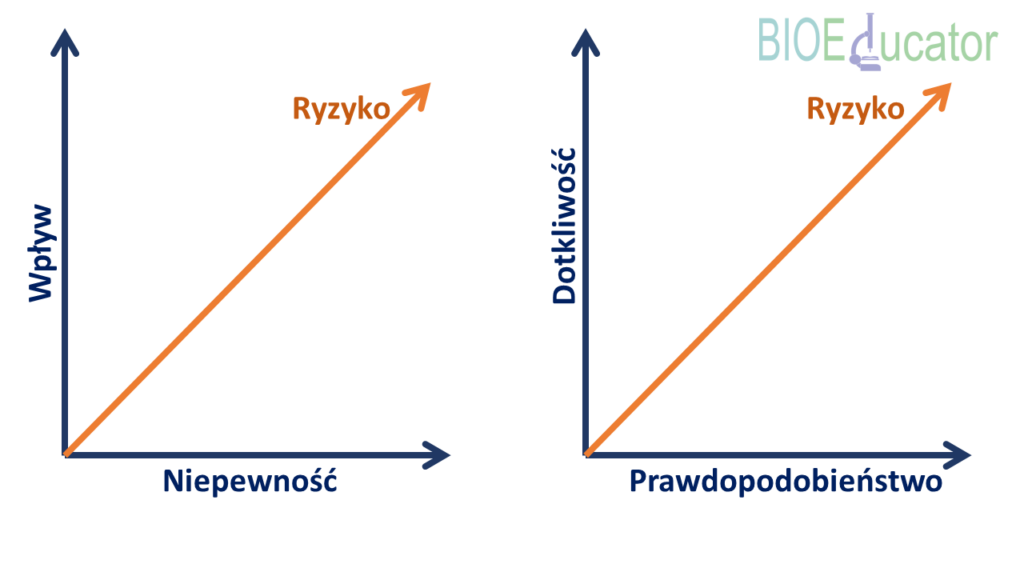
Każdej ocenianej kategorii przypisujemy rangi i punkty, opisując dokładnie jakie są kryteria przypisania do poszczególnej rangi. Każdej randze zaś przypisujemy określoną ilość punktów, których użyjemy do wyliczenia ryzyka.
| Dotkliwość | Opis |
| Bardzo wysoka (9) | Śmierć, infekcja mikrobiologiczna, poważna odpowiedź immunologiczna |
| Wysoka (7) | Progres choroby (z powodu niższej efektywności), poważna odpowiedź immunologiczna |
| Średnia (5) | Umiarkowana immunogenność lub redukcja efektywności |
| Niska (3) | Niski potencjał immunogenny i wpływ na aktywność |
| Bardzo niski (1) | Brak mierzalnego wpływu |
| Prawdopodobieństwo |
| Bardzo wysokie (9) |
| Wysokie (7) |
| Średnie (5) |
| Niskie (3) |
| Bardzo niskie (1) |
Ryzyko obliczamy mnożąc dotkliwość i prawdopodobieństwo. Ryzyku również możemy przypisać rangi uzyskując ostatecznie przypisanie cech jakościowych do czterech kategorii ryzyka.
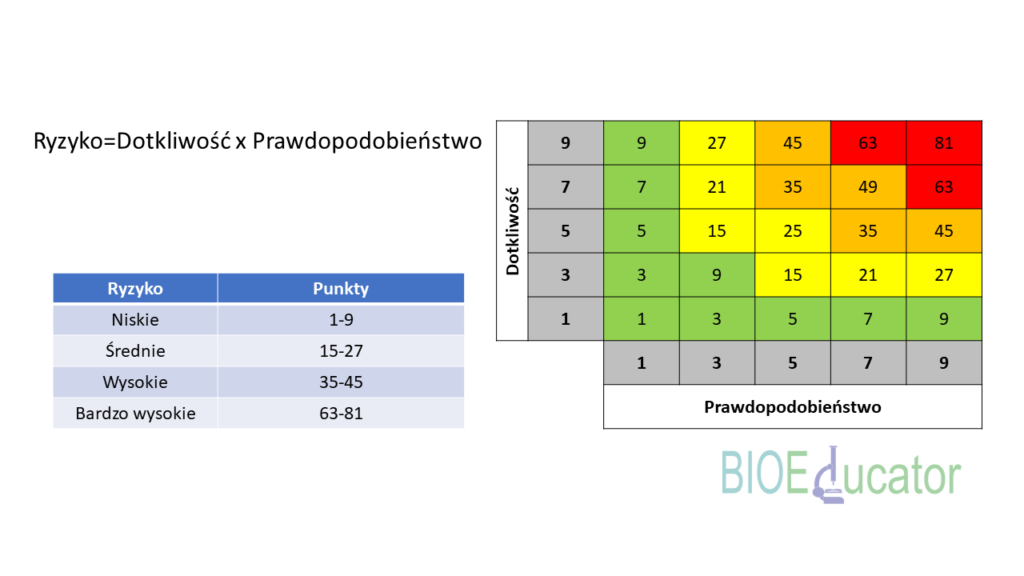
Krytyczne cechy jakościowe – Co dalej?
Celem analizy ryzyka jest podjęcie decyzji o tym co zrobić by ryzyko obniżyć. W przypadku cech jakościowych mamy kilka możliwości, które możemy wziąć pod uwagę:
- Kontrola analityczna w zwolnieniu produktu
- Kontrola analityczna w procesie produkcji
- Optymalizacja procesu by obniżyć ryzyko
- Wykonanie dodatkowych badań by uzyskać wiedzę na temat cechy
W przypadku najbardziej krytycznych cech konieczna będzie kontrola analityczna czy to w trakcie zwolnienia produktu, czy to w analizie wewnątrzprocesowej. Czasami jednak możemy spróbować obniżyć ryzyko poprzez wykonanie dodatkowych badań lub przeprowadzić optymalizację procesu. Taka sytuacja może np. dotyczyć zanieczyszczeń procesowych. Optymalizując proces w celu usunięcia zanieczyszczeń a następnie udowadniając to na etapie charakterystyki i walidacji procesy możemy uniknąć konieczności dodania analizy zwolnieniowej. Analizy, która zawsze będzie dawały wynik poniżej detekcji. Przykładowe drzewko decyzyjne po zakończonej analizie ryzyka przedstawia poniższy schemat
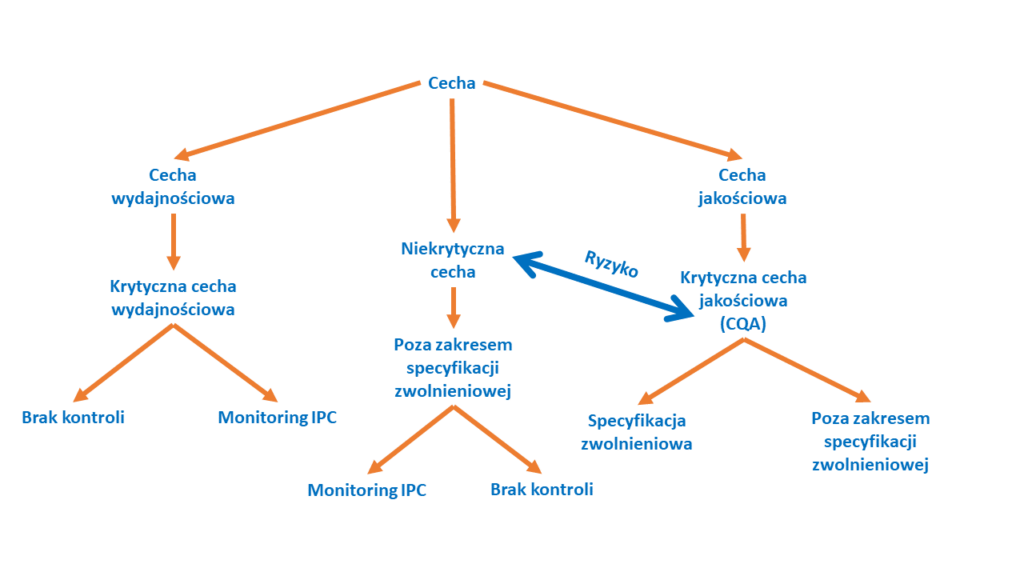
Kiedy spojrzycie na schemat, zauważycie podwójną strzałkę łączącą krytyczną cechę z cechą niekrytyczną. Jest tak dlatego, że krytyczność może się zmienić w czasie. Analizę krytyczności należy wykonać kilkukrotnie. Za każdym razem nasz punkt widzenia będzie inny bo będziemy dysponować inną dawką wiedzy. Często zdarza się, że cecha opisana jako bardzo krytyczna w początkowych etapach rozwoju ma niskie ryzyko w końcowych. Dzięki ponownej analizie ryzyka i podjęciu odpowiednich kroków nie musimy angażować zasobów w kontrolę analityczną tej cechy. Może się również zdarzyć sytuacja odwrotna. Nie dysponując pełną wiedzą błędnie oszacowaliśmy ryzyko lub pojawiły się jakieś nowe czynniki i cecha ma obecnie większą krytyczność.
Krytyczność cech a sposób przedstawiania wyników
Od krytyczności cech zależy również sposób prezentowania wyników badań w dokumentacji rejestracyjnej. Może to być kluczowe zwłaszcza przy opracowaniu produktów biopodobnych, w których musimy pokazać biopodobność produktów. W tym przypadku krytyczność cech determinuje sposób porównania z lekiem referencyjnym. Dla najbardziej krytycznych cech trzeba wykazać brak różnic statystycznych. Dla cech niekrytycznych można pozwolić sobie nie tylko na raportowanie samych wartości ale również na różnice pomiędzy oboma produktami.
Podsumowanie
Identyfikacja krytycznych cech jakościowych jest niezwykle istotna w procesie rozwoju nowego leku. Dzięki temu zabiegowi możliwe jest:
- zaprojektowanie skutecznego i bezpiecznego produktu
- opracowanie procesu
- zaplanowanie kontroli analitycznej.
W celu oceny krytyczności wykorzystujemy różne narzędzia analizy ryzyka. Analizę wykonujemy kilkukrotnie w czasie rozwóju produktu leczniczego. Na podstawie analizy podejmujemy decyzje co do kontroli analitycznej cechy, optymalizacji procesu lub wykonania dodatkowych analiz.
Literatura:
- ICH Q8 – Pharmaceutical development – Scientific guideline
- ICH Q9 – Quality Risk Management
- ICH Q10 – Pharmaceutical Quality System
- ICH Q11 – Development and Manufacture of Drug Substances





Wydaje się, że twój blog emanuje unikalnym głosem i stylem. Czy istnieją jakieś niekonwencjonalne inspiracje, które wpłynęły na rozwój twojego charakterystycznego tonu w tworzeniu treści?