ELISA to skrót od Enzyme-Linked Immunosorbent Assay czyli test immunoenzymatyczny. W wielkim skrócie metoda ELISA wykorzystuje wiązanie przeciwciał z antygenami. Przykładem antygenu może być jedno z białek mleka, które jest alergenem. Po wniknięciu do organizmu wywołuje reakcję immunologiczną, która polega na produkcji przeciwciał skierowanych przeciwko temu białku. Jest to mechanizm wykorzystywany bardzo powszechnie w medycynie, diagnostyce i wielu innych dziedzinach naukowych.

Ogólna zasada działania testu ELISA
Za pomocą testu ELISA wykrywa się antygen lub przeciwciało obecne w próbce.
Test ELISA przeprowadza się najczęściej na płytkach 96-dołkowych. Płytki wykonane są najczęściej z polistyrenu, ale mogą być też pleksiglasowe a nawet ze specjalnych membran lub kulek magnetycznych.
Dno każdego dołka stanowi tak zwana fazę stałą. To do niej przytwierdzi się przeciwciało lub antygen.
Istnieje wiele modyfikacji testu ELISA, o czym w dalszej części artykułu.
Na początek jednak omówimy podstawowe etapy wykonania testu.
Opłaszczanie.
Każdy eksperyment zaczyna się od opłaszczenia płytki. Polega to na nałożeniu do dołków roztworu zawierającego antygen. Jest to najczęściej osocze lub surowica. Jeżeli antygen jest obecny w próbce, łączy się on z podłożem.
Płytkę inkubuje się przez określony czas, najczęściej w temperaturze 37°C lub wyższej (maksymalnie do 56°C, która jest graniczna dla denaturacji białek). Następnie roztwór wylewa się z niezwiązanymi substancjami i przepłukuje się każdy dołek za pomocą roztworu płuczącego.
Blokowanie
Kolejnym, bardzo ważnym etapem, jest blokowanie miejsc w fazie stałej niezajętych przez antygen. Jest to o tyle istotne, że gdyby zostawić je wolne, mogłyby się do nich przyłączyć przeciwciała lub antygeny stosowane w dalszych etapach, co mogłoby w znaczący sposób zaburzyć ostateczny wynik. Do blokowaniu używa się najczęściej owoalbuminy (białka jaja kurzego) lub odtłuszczonego mleka. Ten etap również kończy się inkubacją i płukaniem.
Dodanie przeciwciał skoniugowanych z enzymem
W przypadku, kiedy płytkę opłaszczaliśmy antygenem, w najprostszej wersji nakładamy na opłaszczoną płytkę roztwór przeciwciał skierowanych przeciwko badanemu antygenowi. Jeżeli antygen był obecny w próbce, przeciwciała przyłączają się do niego. Przeciwciała znakowane są enzymem (najczęściej peroksydazą chrzanową, fosfatazą alkaliczną lub oksydazą glukozową). Po inkubacji niezwiązane przeciwciała wypłukuje się.
Detekcja
Do dołków dodaje się substratu dla enzymu, którym znakowane były przeciwciała. W wyniku reakcji enzym-substrat powstaje produkt barwny. Intensywność barwy jest wprost proporcjonalna do stężenia antygenu związanego z fazą stałą. Mierzy się ją spektrofotometrycznie i oblicza w odniesieniu do krzywej kalibracyjnej przygotowanej każdorazowo dla każdego eksperymentu na podstawie wzorców stężenia. Co istotne, po dodaniu substratu następuje inkubacja, której czas jest bardzo istotny i ściśle określony w metodzie. Należy pamiętać, że na tym etapie nie wykonujemy płukania.
Test bezpośredni ELISA
Jest to najprostsza wersja testu ELISA, która nie różni się od ogólnego opisu metody przedstawionego powyżej. W tym przypadku płytkę opłaszcza się antygenem. Wolne miejsca na fazie stałej blokuje się za pomocą roztworu blokującego. Kolejny etap to dodatek przeciwciał znakowanych enzymem. Następnie dodaje się substrat. W wyniku reakcji enzym-substrat powstaje barwny produkt. Intensywność koloru jest wprost proporcjonalna do stężenia antygenu w próbce badanej.
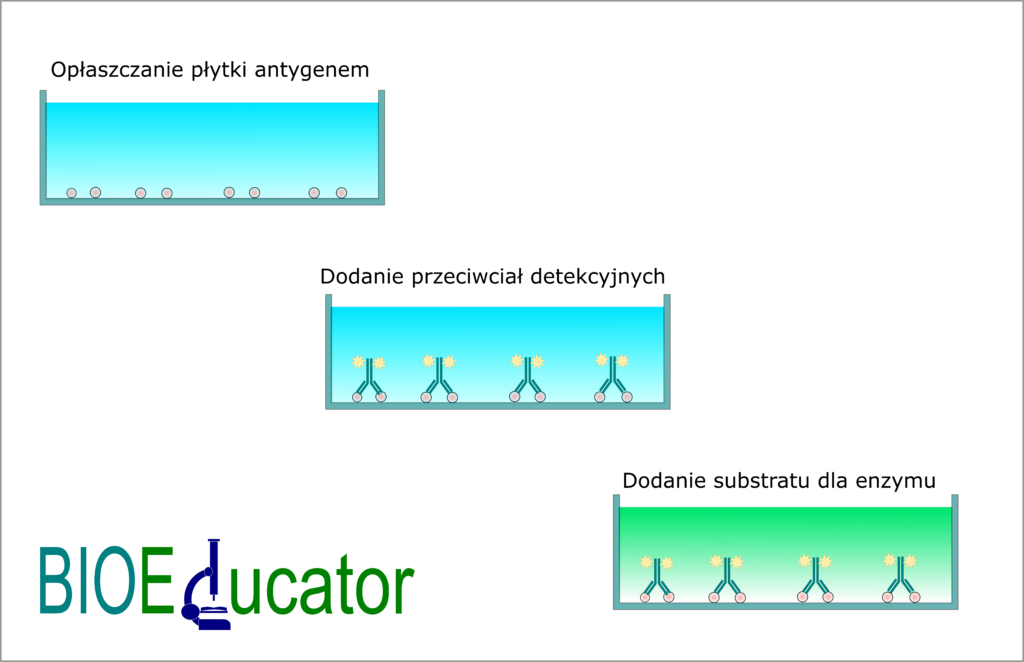
Należy pamiętać, że każdy etap kończy się inkubacją i wypłukaniem niezwiązanych składników. Wyjątek stanowi dodatek substratu, gdzie po inkubacji następuje pomiar.
Test pośredni ELISA
W teście pośrednim płytkę opłaszcza się antygenem. Tak jak w teście bezpośrednim dodaje się przeciwciała skierowane przeciwko antygenowi. Różnica polega na tym, że nie jest ono znakowane enzymem. Nazywamy je przeciwciałem pierwszorzędowym. Dopiero w kolejnym etapie dodaje się drugie przeciwciało, czyli tak zwane przeciwciało drugorzędowe. To właśnie ono zawiera enzym. Kolejne etapy przebiegają identycznie jak w teście bezpośrednim, czyli dodatek substratu wywołuje barwną reakcję, której intensywność skorelowana jest bezpośrednio ze stężeniem antygenu.
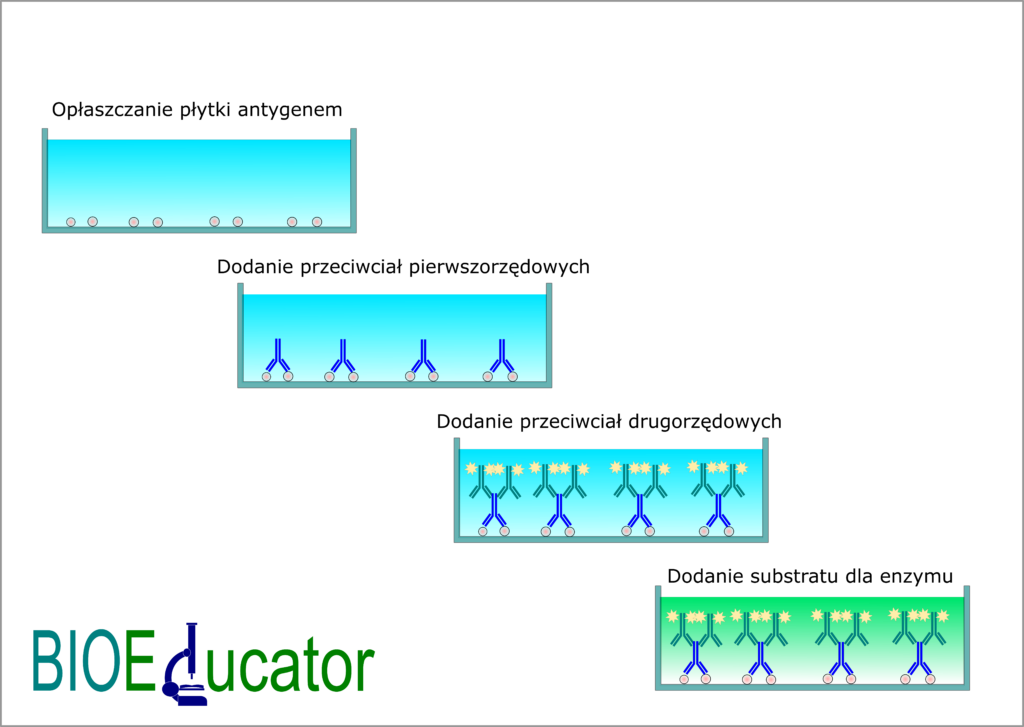
Tak samo, jak wyżej, inkubacja i płukanie następują po każdym etapie. Płukanie należy pominąć jedynie po dodaniu substratu.
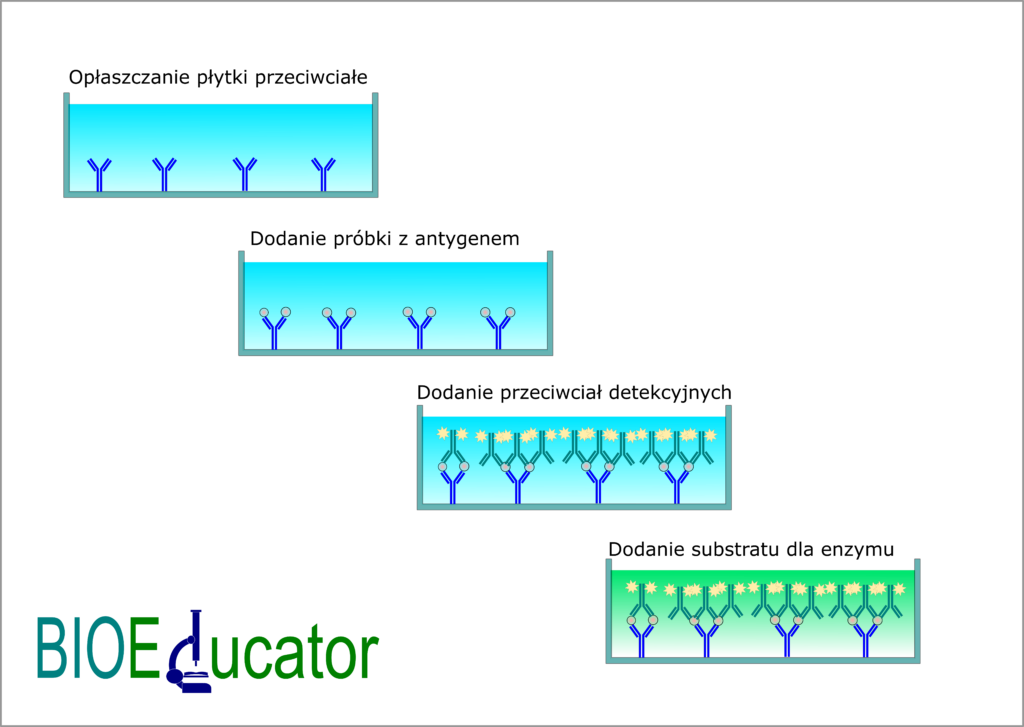
Sandwitch czyli ELISA kanapkowa
Tu płytka opłaszczana jest przeciwciałem, a nie antygenem. Następnie, po zablokowaniu wolnych miejsc, dodaje się antygen. Łączy się on z unieruchomionymi w fazie stałej przeciwciałami. Dopiero z tym antygenem łączy się przeciwciało pierwszorzędowe dodane w kolejnym etapie. Dalsza część przebiega tak samo jak opisany powyżej teście pośredni. Dodaje się roztwór przeciwciał drugorzędowych znakowanych enzymem. Powstaje w ten sposób coś na kształt kanapki, skąd nazwa tej modyfikacji testu ELISA. Następnie po dodaniu substratu zachodzi barwna reakcja. Intensywność barwy zależy od stężenia antygenu.
Test kompetycyjny, czyli competitive ELISA
To, co wyróżnia ten test na tle innych modyfikacji, jest wykorzystanie konkurencji o wiązanie przeciwciał lub antygenów z próbki ze znakowanymi przeciwciałami lub antygenami. Płytka może zostać opłaszczona antygenem lub przeciwciałem.
Jeżeli opłaszczamy płytkę antygenem, w kolejnym etapie, po zablokowaniu wolnych miejsc w fazie stałej, dodajemy mieszaninę przeciwciał znakowanych enzymem oraz tych pochądzących z próbki. W czasie inkubacji zachodzi konkurencja o miejsce wiązania antygenu pomiędzy znakowanymi i nieznakowanymi przeciwciałami. Im więcej jest przeciwciał w próbce badanej(czyli tych nieznakowanych) tym więcej przyłączy się ich do unieruchomionego w fazie stałej antygenu. Pozostałe miejsca zostają zajęte przez przeciwciała znakowane enzymem. Po dodaniu substratu następuje reakcja barwna. Jej intensywność jednak jest odwrotnie proporcjonalna do stężenia badanego przeciwciała. Krótko mówiąc, im więcej przeciwciał w próbce, tym sygnał jest słabszy, ponieważ mniej znakowanych przeciwciał połączyło się z antygenem.
Można wykonać modyfikację , która będzie swego rodzaju odwróconym testem ELISA. Jeżeli płytkę opłaszczamy przeciwciałem, po zablokowaniu wolnych miejsc w fazie stałej nakładamy mieszaninę antygenów: znakowanych o znanym stężeniu oraz tych z próbki badanej. Tak jak poprzednio, po dodaniu substratu, zachodzi barwna reakcja. Jej intensywność jest odwrotnie proporcjonalna do stężenia nieznakowanego antygenu w próbce badanej.
Do czego używamy testu ELISA? Którą z modyfikacji wybrać?
Za pomocą testu ELISA można wykryć antygeny lub przeciwciała obecne w różnych próbkach biologicznych. Najczęściej jest to surowica, ale bada się się je również w moczu lub na przykład w supernatancie komórek. Metodę tę stosuje się do wykrywania infekcji, jak na przykład obecność przeciwciał przeciwko wirusowi HIV oznacza jego nosicielstwo. Medycyna laboratoryjna dysponuje całą gamą gotowych testów, za pomocą których wykrywa się różne choroby. Obecność alergenów, którymi są najczęściej białka również można określić metodami innunometrycznymi, do których zalicza się test ELISA.
Jeżeli zdecydujemy się na test bezpośredni, musimy dysponować wyznakowanym przeciwciałem skierowanym specyficznie przeciwko danemu antygenowi. Mimo, że jest to najłatwiejszy w wykonaniu test, jego ograniczeniem jest konieczność posiadania wielu wyznakowanych przeciwciał dla każdego antygenu (przeciwciał monoklonalnych). Ponadto musimy pamiętać, że podczas opłaszczania analit współzawodniczy ze składnikami matrycy. Jeśli jest go mało, wpłynie to istotnie na obniżenie czułości metody.
Mimo, że test pośredni posiada więcej etapów, stanowi duże ułatwienie w porównaniu z testem bezpośrednim. Nie trzeba posiadać wyznakowanych przeciwciał monoklonalnych dla każdego antygenu. Wystarczy posiadać nieznakowane przeciwciała monoklonalne. Znakowane muszą być tylko przeciwciała drugorzędowe. Te z kolei nie muszą być specyficzne, ale wystarczy, że będą np. antyludzkie (czyli skierowane przeciwko przeciwciałom ludzkim). Taki rodzaj przeciwciał nazywamy poliklonalnymi.
Test kanapkowy z kolei może okazać się dobrym wyborem ,jeżeli zależy nam na dokładnym wyznaczeniu zawartości białka w badanej próbce. Dzięki opłaszczaniu płytki przeciwciałami, które specyficznie wychwytują analit, składniki matrycy nie wpływają negatywnie na czułość metody. Nic więc dziwnego, że ELISA kanapkowa stała się swego rodzaju złotym standardem w rutynowych komercyjnych zastosowaniach.
Grafika:





Przechodząc przez fascynujące wpisy na twoim blogu, zastanawiam się, czy korzystasz z jakichś specjalnych technik SEO, aby zwiększyć widoczność swoich treści w wyszukiwarkach internetowych? Może masz jakieś wskazówki dla innych, którzy chcieliby poprawić pozycję swojego bloga?
Przede wszystkim pisze na podstawie swojego doświadczenia jako naukowca i szkoleniowca. Korzystam z Yoast SEO, głównie by skorygować wpisy i upewnić się, że wszystko jest tak jak być powinno.