Wiedza na temat zawartości białka w próbce jest niezbędna w laboratorium. Pozwala ona poprawnie wykonać wiele innych oznaczeń laboratoryjnych (np. SDS-page) czy dobrać warunki oczyszczania (np. ładunek kolumny chromatograficznej). Jest również istotnym pomiarem w trakcie produkcji białek. Umożliwia przygotowanie odpowiednich rozcieńczeń czy monitorowanie procesu oczyszczania.

Istnieje kilka technik oznaczania zawartości białka. Wykorzystują one różne mechanizmy a różnią się czułością, dokładnością i szybkością pomiaru.
1. Pomiar Absorbancji UV-VIS przy Długości Fali 280 nm
Podstawą metody pomiaru absorbancji przy długości fali 280 nm jest zdolność aminokwasów aromatycznych (tryptofanu i tyrozy oraz fenyloalaniny) do absorpcji światła z maksimum właśnie przy długości 280 nm. Zgodnie z prawem Lamberta-Beera, absorbancja jest proporcjonalna do stężenia białka (A=еCl). Dla czystych próbek, znając współczynnik ekstynkcji, jesteśmy w stanie dokłanie zmierzyć zawartość białka w próbce.
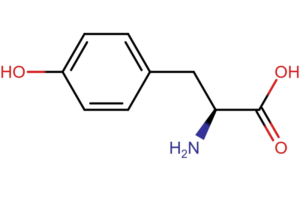
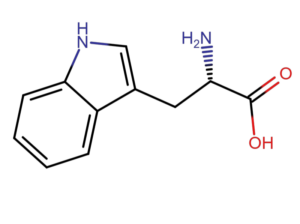
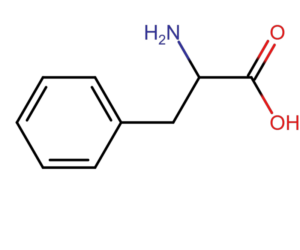
Metoda pomiaru absorbancji przy długości fali 280 nm na jednak wadę. Każde białko ma inny skład aminokwasowy i inną zawartość aminokwasów aromatycznych. W przypadku bardzo złożonych próbek lub gdy w matryce znajdują się aminokwasy lub kwasy nukleinowe, wynik jest niedokładny.
Metoda Mikrobiuretowa
Metod mikrobiuroetowa jest modyfikacją tradycyjnej metody biuretowej. Umożliwia jednak pomiar dla mniejszych objętości próbki. Podstawą techniki jest reakcja wiązań peptydowych z jonami miedzi w silnie zasadowym środowisku. Do zajścia reakcji niezbędne są minimum dwa wiązania peptydowe. Wolne aminkowasy ani dwupeptydy nie będą więc dawały pozytywnego wyniku. Nazwa metody, nie pochodzi wbrew pozorom od biurety, lecz od biuretu. Biuret to najprosztszy związek, który daje pozytywną reakcję.
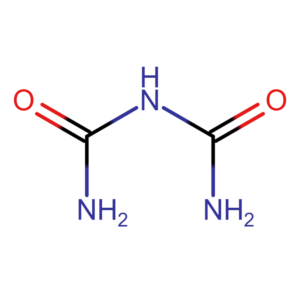
Reakcja została opisana w 1833 roku przez Ferdinanda Rosiego i niezależnie w 1857 r przez Gustawa Piotrowskiego. Wynik jest niezależny od składu aminokwasowego białka. W wyniku reakcji powstaje barwny kompleks miedzi z białkiem (kolor fioletowy). Wykazuje on maksimum absorpbcji przy długości fali 310 nm oraz 505 nm. Pomiar przy długości fali 310 nm może być mniej czuły ze względu na możliwość interferencji. Z tego powodu pomiaru częto dokonuje się przy długości 540 nm.
2. Metoda Lowry’ego (Folina-Ciocalteu)
Metoda Lowry’ego jest udoskonaleniem metody biuretowej. U jej podstaw leży dwuetapowa reakcja chemiczna. Pierwsza reakcja jest typową reakcją Piotrowskiego wykorzystywaną w metodzie biuretowej. W wyniku reakcji z wiązań peptydowych z jonami miedzi powstają barwne kompleksy.
W drugiej reakcji wykorzystuje się odczynnik Folina – Cocalteu. Odczynnik ten używany jest zazwyczaj do wykrywania aminokwasów aromatycznych w białkach (tyrozyny i tryptofanu). Podstawą reakcji jest redukcja soli kwasu fosfowolframowego i fosfomolibdenowego przez reszty aminokwasów aromatycznych i kompleksy miedziowe. Do reakcji zachodzi w środowisku zasadowym (pH 10). W efekcie powstają barwne produkty. Natężenie koloru jest wprost proporcjonalne do ilości białka.
Metoda jest bardzo czuła. Pozwala na wykrycie już 1 μg/ml białka. Jest około 100 razy czulsza od metody biuretowej. Niestety z uwagi na udział tyrozyny i tryptofanu w reakcji, jej wynik jest zależny od składu aminokwasowego białek.
Uwaga! Reakcja zachodzi w pH 10. W tych warunkach kwas fosfomolibdenowy jest nietrwały i szybko ulega redukcji do kwasu ortofosforowego. Z tego powodu próbkę należy szybko wymieszać by zapewnić, że kwas fosfomolibdenowy przereaguje z białkiem.
W wyniku reakcji powstaje niebieski kolor, który można zmierzyć przy długości fali 650 – 750 nm
3. Metoda Bradforda (Barwnik Coomassie Brilliant Blue G-250)
Technika Bradforda jest jedną z najczęściej używanych. Jest szybka a jednocześnie zapewnia dość dużą czułość. Podstawą techniki jest reakcja barwnika Coomassie Brillian Blue G-250 z białkami. Zachodząca w środowisku kwaśnym reakcja polega na tworzeniu wiązań jonowych i hydrofobowoych z niektórymi aminokwasami. Z barwnikiem reaguje głównie arginina a w mniejszym stopniu również histydyna, lizyna, tyrozyna, tryptofan i fenyloalanina. Powstaly kompleks jest niebieski z maksimum absorpcji przy długości fali 595 nm. Pomiar jest niezwykle prosty. Do próbki wystarczy dodać odczynnika i po około 5 minutach przystąpić do odczytu. Metoda podobnie jak metoda Lowryego może dawać różne wyniki w zależności od białka z powodu różnic w składzie aminokwasowym. Ponadto niektóre detergenty takie jak SDS, Triton-X czy Tween mogą reagować z odczynnikiem i dawać interferujący kolor.

Uwaga! Jeśli w próbce znajdują się detergenty (np. lizaty komórkowe, białka błonowe) warto zastosować próbkę ślepą z dodatkiem detergentów by wyeliminować interferencję.
4. Metoda BCA (Kwas Bicinchoninowy)
Metoda BCA jest modyfikacją metody Lowry’ego. Podobniej jak w niej jest dwuetapowa. W pierwszym etapie zachodzi reakcja Piotrowskiego. Wiązania peptydowe redukują jony miedzi. Te reagują z kwasem bicinchninowym (BCA). W efekcie powstaje stabilny barwny kompleks o kolorze purpurowym. Absorbancję produktu mierzy się przy długości fali 566 nm.
Metoda BCA jest bardzo czuła. Wykrywa niższe stężenia białka niż metoda Lowry’ego a jednocześnie jej wynik nie jest zależny od składu aminokwasowego. Wada jest to, że jest wrażliwa na obecność reduktorów w próbce oraz na obecność środków chelatujących takich jak EDTA.
Porównanie Technik Oznaczania Zawartości Białka
Poszczególne techniki oznaczania białka różnią się od siebie czułością, szybkością wykonania, dokładnością wyniku i podatnością na interferencję ze składnikami matrycy. Poniższa tabelka umożliwi Ci dokonanie wyboru.
| Metoda | Czułość i zakres | Szybkość pomiaru | Dokładność | Interferencje |
| Pomiar absorbancji przy dł fali 280 nm | Niska (0,1 – 3 mg/ml) | Bardzo szybka | Średnia (zależy od składu białka) | Podatna na zanieczyszczenia kw. Nukleinowymi i aminokwasami |
| Metoda mikrobiuretowa | Niska (1 – 10 mg/ml) | Średnia (10 – 20 minut) | Wysoka (niezależny od składu białek) | Odporna na skład matrycy |
| Metoda Lowry’ego | Wysoka (0,01 – 1 mg/ml) | Wolna (40 – 60 minut) | Wysoka (częściowo zależy od składu) | Podatna na zanieczyszczenia detergentami |
| Metoda Bradforda | Wysoka (0,005 – 2 mg/ml) | Szybka (około 5 minut) | Średnia (zależna od składu białek) | Podatna na zanieczyszczenia detergentami |
| Metoda BCA | Wysoka (0,005 – 2 mg/ml) | Niska (30 – 60 minut) | Wysoka (niezależna od składu białek) | Podatna na zanieczyszczenia reduktorami |
Podsumowanie
Wybór odpowiedniej metody kwantyfikacji białka zależy od specyfiki próbki (np. obecność detergentów czy substancji zakłócających), wymaganego zakresu stężeń oraz dostępnego czasu i sprzętu.
- Dla szybkich, nieinwazyjnych pomiarów wstępnych idealny jest UV 280 nm.
- Dla najwyższej czułości i szybkości (w próbkach bez detergentów) króluje Bradford.
- Dla najwyższej dokładności polecam metodę BCA.
- Metoda Lowry’ego i Mikrobiuretowa są rzadziej stosowane, choć Lowry’ego nadal bywa wykorzystywana w specyficznych aplikacjach.
Uwaga! Pamiętaj, że przy doborze techniki pomiarowej należy mieć na uwadze nie tylko jej łatwość i szybkość ale również czułość i skład próbek, które chcesz zmierzyć. Dopasuj metodę do swoich potrzeb.
Literatura
Kłyszejko-Stefanowicz, L. (red.). (2003). Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN.
Wilson, K., Walker, J. (2010). Principles and Techniques of Biochemistry and Molecular Biology.
Grafika
Helito, CC BY-SA 4.0 https://creativecommons.org/licenses/by-sa/4.0, via Wikimedia Commons
Grafika własna
