SDS-PAGE (ang. Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis), to jedna z najczęściej stosowanych technik w biologii molekularnej i biochemii. Pozwala ona na rozdział białek wyłącznie na podstawie ich masy cząsteczkowej.
1. Jak działa SDS – PAGE?
Istotą elektroforezy jest ruch naładowanych cząsteczek w polu elektrycznym. Prędkość migracji w trakcie tego procesu jest wypadkową trzech cech: ładunku cząsteczki, wielkości i kształtu. W warunkach natywnych białka różnią się tymi wielkościami.
Zastosowanie SDS denaturuje białka (rozplata je) i nadaje jednolity ujemny ładunek. Dzięki temu możliwy jest ich elektroforetyczny rozdział w oparciu tylko i wyłącznie o masę.
2. Właściwości SDS (Siarczan dodecylu sodu)
SDS to anoniowy detergent, który jest kluczowym składnikiem tej metody. Spełnia on trzy funkcje:
- Niszczy wiązania niekowalencyjne: SDS rozrywa wiązania wodorowe i oddziaływania hydrofobowe, powodując denaturację białka.
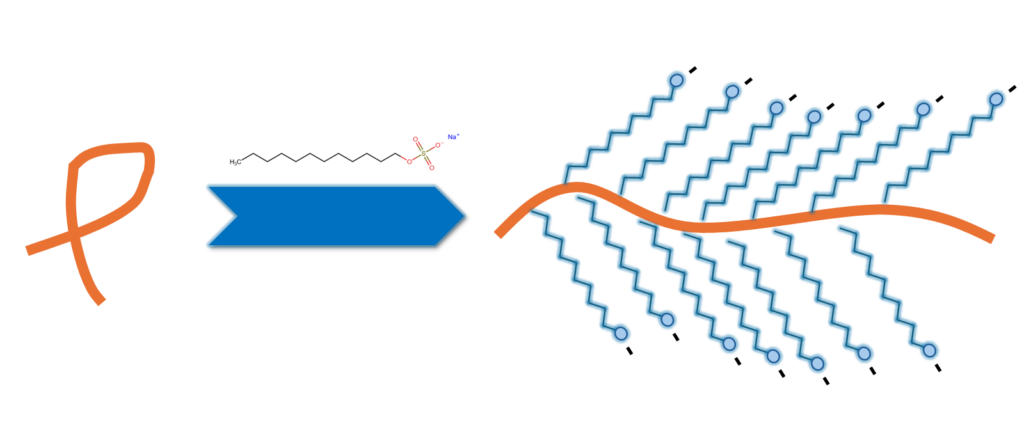
- Maskuje ładunek: SDS wiąże się z białkami w stałym stosunku masowym – około 1,4 g SDS na 1 g białka. Wiązanie odbywa się z hydrofobowymi regionami białka. Na zewnątrz skierowana jest naładowana ujemnie końcówka SDS. Ujemny ładunek, maskuje naturalne ładunki aminokwasów. W rezultacie wszystkie białka w próbce stają się naładowane ujemnie, a stosunek ładunku do masy jest dla nich stały.
- Linearyzacja: Dzięki odpychaniu się grup ujemnych SDS, łańcuch polipeptydowy przyjmuje postać zbliżoną do pręta/włókna.
Ważne: Białka zawierające mostki dwusiarczkowe nie ulegną całkowitej denaturacji bez ich redukcji. Aby w pełni zdenaturować białka zawierające mostki dwusiarczkowe (S-S), do buforu obciążającego dodaje się reduktor, taki jak β-merkaptoetanol lub DTT (ditiotreitol).
3. Jak przygotować próbkę do SDS-PAGE?
Aby przygotować próbkę do SDS-Page należy najpierw poznać zawartość białka w próbce. W tym celu należy posłużyć się jedną z technik oznaczania zawartości białek.
Próbkę należy rozcieńczyć do odpowiedniego stężenia. Próbka nie może być zbyt rozcieńczona (prążki białek o niższym stężeniu będą zbyt blade lub niewidoczne) ani zbyt stężona (prążki będą się łączyć i rozlewać). Oto kilka zasad, których warto przestrzegać:
Na żel należy nakładać:
- 10-50 μg białka z lizatu komórkowego
- 10-100 ng białka oczyszczonego
Typowa objętość jaką wprowadza się do studzienek to 5 – 35 μl.
Odpowiednio rozcieńczoną próbkę miesza się z buforem ładującym (obciążeniowym), w którego składzie znajduje się SDS i DTT lub β-merkaptoetanol. Próbkę należy ogrzewać w 95 °C przez kilka minut by zredukować mostki dwusiarczkowe. Bufor ładujący zawiera zazwyczaj barwnik, dzięki któremu można śledzić migrację czoła rozdziału elektroforetycznego. Dzięki zawartości glicerolu lub sacharozy ma dużą gęstość dzięki czemu próbka osiada na dnie studzienki. Stąd jego częsta nazwa – bufor obciążeniowy.
Po ostudzeniu próbkę wprowadza się do studzienek w żelu zagęszczającym.
4. Wybór gęstości żelu
Żel poliakryloamidowy powstaje w wyniku polimeryzacji monomerów akryloamidu usieciowanych bis-akryloamidem. Wielkość porów w „sicie” zależy od stężenia akryloamidu.
Zasada jest prosta:
- Wysoki procent akryloamidu (gęsty żel): Małe pory, idealne do rozdziału małych białek.
- Niski procent akryloamidu (rzadki żel): Duże pory, idealne do rozdziału dużych białek.
| Stężenie akryloamidu (%) | Zakres rozdziału (kDa) | Przykładowe zastosowanie |
| 7-8% | 50 – 500 kDa | Duże enzymy, kompleksy białkowe |
| 10% | 20 – 300 kDa | Uniwersalny zakres |
| 12-15% | 10 – 100 kDa | Typowe białka cytozolowe |
| >15% | < 20 kDa | Małe peptydy |
Warto pamiętać o strukturze żelu nieciągłego (system Laemmliego), który składa się z dwóch warstw:
- Żel zagęszczający (Stacking gel): Górny, rzadki żel o niższym pH (6.8), który kompresuje próbkę w wąski prążek. Podczas przechodzenia z żelu zagęszczającego do rozdzielającego białka układają się w odpowiedniej kolejności i zagęszczają, dzięki czemu prążki są cienkie i wyraźne.
- Żel rozdzielający (Resolving gel): Dolny, gęstszy żel o wyższym pH (8.8), gdzie następuje właściwy rozdział według masy.
5. Budowa aparatu do elektroforezy
Standardowy zestaw do SDS-PAGE to układ do elektroforezy pionowej.
Główne elementy to:
- Komora (Tank): Wypełniona buforem elektrodowym, zapewnia chłodzenie i przewodnictwo.
- Płytki szklane: Między nimi wylewany jest żel.
- Przekładki (Spacers): Określają grubość żelu (zazwyczaj 0.75 mm – 1.5 mm).
- Grzebień (Comb): Tworzy studzienki, do których nakłada się próbki.
- Elektrody:
- Katoda (-): Umieszczona na górze (białka ujemne uciekają od niej).
- Anoda (+): Umieszczona na dole (białka ujemne dążą do niej).
- Zasilacz: Generuje pole elektryczne (stałe napięcie lub natężenie).
6. Dobór warunków rozdziału SDS-PAGE
Sukces elektroforezy zależy od prawidłowo dobranych parametrów prądu i buforów.
- Bufor elektrodowy: Najczęściej stosuje się bufor Tris-Glicyna-SDS. Glicyna odgrywa kluczową rolę w procesie „stackingu” (zagęszczania) białek na granicy żeli.
- Napięcie (V):
- Podczas przechodzenia przez żel zagęszczający stosuje się niższe napięcie (np. 80-100 V), aby białka równo weszły w żel.
- W żelu rozdzielającym napięcie się zwiększa (np. 120-150 V).
- Temperatura: Przepływ prądu generuje ciepło (prawo Joule’a). Zbyt wysoka temperatura powoduje szybszą migrację bialek na brzegach. W efekcie na elektroforegramie widoczne są tzw. „uśmiechnięte prążki”. Z tego powodu aparat do elektroforezy wyposażony jest w układ chłodzenia (np. przepływowy). Jeśli go nie posiada rozdział można przeprowadzać w chłodziarce.
7. Wybarwianie żelu
Po zakończeniu elektroforezy białka są niewidoczne. Należy je utrwalić i wybarwić.
- Czerwień Coomassie (Coomassie Brilliant Blue R-250/G-250): Najpopularniejsza metoda. Barwnik wiąże się niespecyficznie z białkami.
- Barwienie solami srebra (Silver Staining):
- Zalety: Bardzo wysoka czułość (wykrywa nawet 1 ng białka).
- Wady: Czasochłonne, wymaga stosowania toksycznych odczynników, trudne do odwrócenia.
- Barwienie fluorescencyjne (np. SYPRO Ruby): Wymaga specjalnego skanera, ale oferuje szeroki zakres liniowości (dobre do analizy ilościowej).
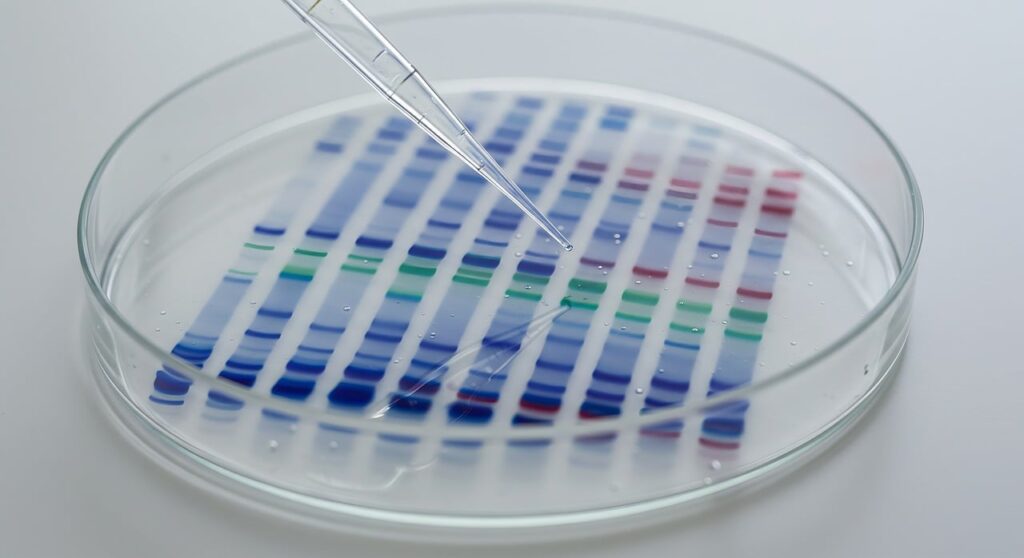
7. Analiza wyników
Aby określić wielkość badanego białka, na ten sam żel nakłada się tzw. Marker Wielkości (Drabinę Białkową) – mieszaninę białek o znanych masach.
Analiza przebiega następująco:
- Porównujemy położenie prążka naszej próbki z prążkami markera.
- Dla precyzyjnych obliczeń wyznacza się współczynnik Rf (odległość migracji białka / długość żelu).
- Istnieje liniowa zależność między logarytmem masy cząsteczkowej (log Mw) a drogą migracji.
8. Zastosowanie
Technika SDS-PAGE jest powszechnie stosowana w laboratoriach na całym świecie. Główne zastosowania to:
- Szacowanie masy cząsteczkowej: Identyfikacja nieznanych białek na podstawie ich wielkości.
- Ocena czystości preparatu: Jeśli po oczyszczaniu białka na żelu widzimy tylko jeden prążek, preparat jest czysty. Wiele prążków oznacza zanieczyszczenia.
- Western Blotting: SDS-PAGE jest pierwszym etapem tej techniki (przeniesienie białek z żelu na membranę w celu detekcji przeciwciałami).
- Monitorowanie ekspresji białek: Porównanie lizatów komórkowych przed i po indukcji produkcji białka.
Literatura
Berg, J. M., Tymoczko, J. L., Gatto, G. J., & Stryer, L. (2018). Biochemia. Wydawnictwo Naukowe PWN.
Hames, B. D. (1998). Gel electrophoresis of proteins: A practical approach. Oxford University Press.
