Pasażowanie komórek adherentnych wymaga ich oderwania od podłoża. Jak pisaliśmy we wcześniejszych artykułach, najczęstszą metodą jest trypsynizacja.
Choć procedura ta wydaje się prosta, jej nieprawidłowe przeprowadzenie jest jedną z najczęstszych przyczyn niskiej żywotności komórek oraz utraty ich fenotypu. Zrozumienie molekularnych podstaw adhezji i enzymatycznego trawienia białek pozwoli Wam nie tylko lepiej planować swoje prace, ale i skutecznie rozwiązywać problemy.
Jak komórki przytwierdzają się do podłoża?
By poznać sens procesu trypsynizacji, musimy się najpierw pochylić nad samym przyleganiem komórek do podłoża. Większość komórek ssaków w warunkach in vitro przylega do podłoża. Mówimy, że są adherentne. Do przeżycia i proliferacji wymagają one fizycznego kontaktu z odpowiednim podłożem. Nie jest to jednak proste „przyklejenie się”. To aktywny proces biologiczny angażujący wyspecjalizowane białka i struktury.
Macierz zewnątrzkomórkowa (ECM)
Komórki wydzielają białka tworzące macierz zewnątrzkomórkową (Extracellular Matrix – ECM), taką jak kolagen, laminina czy fibronektyna. Tworzą one swoisty „dywan”, do którego komórka kotwiczy się za pomocą receptorów powierzchniowych. Warto tu podkreślić, że większość współeczesnych naczyń hodowlanych takich jak płytki czy butelki hodowlane jest pokryta kolagenem. Ma on za zadaniem ułatwić komórkom przyczepienie się do podłoża.
Białka adhezyjne: Integryny i Kadheryny
Kluczową rolę odgrywają integryny – transbłonowe receptory, które łączą cytoszkielet aktynowy komórki z białkami ECM. Kluczem do działania integryn są dwuwartościowe kationy: Ca2+ Mg2+.
Oprócz kontaktu z podłożem, komórki tworzą połączenia między sobą (cell-to-cell junctions), w których główną rolę grają kadheryny. Są one kluczowe dla zachowania integralności monowarstwy i, co istotne, ich funkcja jest całkowicie zależna od obecności jonów wapnia.
Jak działa trypsyna?
Trypsyna to proteaza serynowa naturalnie występująca w układzie pokarmowym ssaków (wytwarzana w trzustce). W hodowlach in vitro wykorzystuje się jej zdolność do hydrolizy wiązań peptydowych.
Swoistość cięcia
Trypsyna wykazuje wysoką specyficzność: przecina łańcuchy polipeptydowe po karboksylowej stronie aminokwasów zasadowych – lizyny (Lys) oraz argininy (Arg), o ile po nich nie następuje prolina.
W kontekście hodowli komórkowej, trypsyna:
- Trawi domeny zewnątrzkomórkowe integryn, odcinając komórkę od ECM.
- Degraduje białka macierzy, rozluźniając strukturę „dywanu” białkowego.
- Rozbija połączenia międzykomórkowe, co pozwala na uzyskanie zawiesiny pojedynczych komórek.
Długotrwałe działanie trypsyny jest jednak toksyczne. Enzym ten nie odróżnia białek adhezyjnych od innych białek błonowych (np. receptorów dla czynników wzrostu), dlatego kluczowe jest ścisłe kontrolowanie czasu inkubacji.
Jak przygotować komórki do trypsynizacji?
Zanim dodamy enzym, musimy odpowiednio przygotować środowisko. Standardowy protokół zakłada zlanie pożywki hodowlanej i dwukrotne przepłukanie monowarstwy buforem PBS (Phosphate Buffered Saline) bez jonów wapnia i magnezu. Dlaczego to takie ważne?
- Inhibitory w surowicy: Większość pożywek (np. DMEM, RPMI) suplementowana jest płodową surowicą bydlęcą (FBS). FBS zawiera bogactwo inhibitorów proteaz, takich jak α-antytrypsyna. Jeśli nie usuniemy dokładnie resztek surowicy, dodana trypsyna zostanie natychmiast zneutralizowana i nie zadziała.
- Rola jonów dwuwartościowych: Jak wspomniano, adhezja komórek jest zależna od Ca2+ i Mg2+. Obecność tych jonów w pożywce stabilizuje strukturę białek adhezyjnych, czyniąc je mniej podatnymi na trawienie enzymatyczne. Płukanie buforem PBS (wolnym od tych jonów) osłabia te wiązania, „przygotowując” białka do cięcia.
Wskazówka ekspercka: Do roztworów trypsyny zazwyczaj dodaje się EDTA (kwas wersenowy). Jest to czynnik chelatujący, który wiąże jony Ca2+ i Mg2+, dodatkowo wspomagając proces dysocjacji komórek poprzez „rozszczelnienie” połączeń kadherynowych.
Trypsynizacja krok po kroku
Poniżej znajduje się standardowa procedura dla butelki hodowlanej typu T-25:
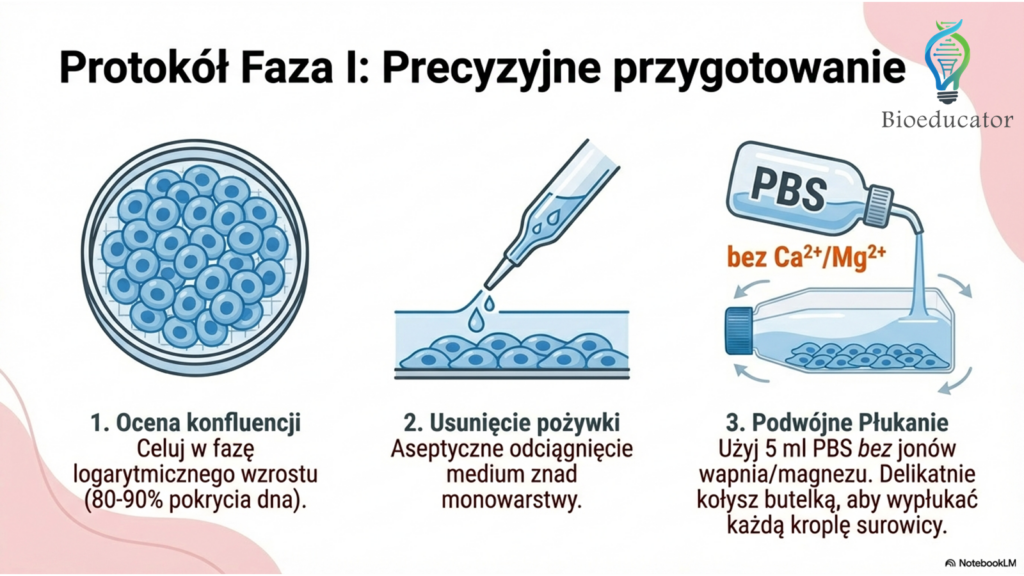
- Ocena mikroskopowa: Sprawdź konfluencję (stopień pokrycia dna). Najlepiej pasażować komórki w fazie logarytmicznego wzrostu (ok. 80-90% konfluencji).
- Aseptyczne usunięcie pożywki: Odciągnij pożywkę znad monowarstwy.
- Płukanie (2x): Dodaj ok. 5 ml PBS (bez jonów wapnia i magnezu). Delikatnie przemyj dno (np. przez kołysanie) i odciągnij płyn. Powtórz.
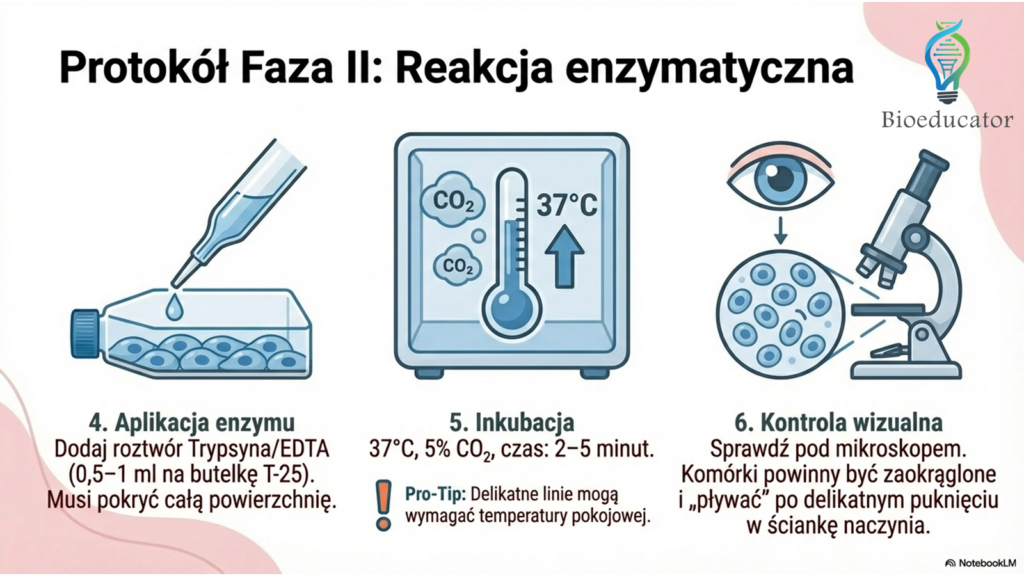
- Dodanie trypsyny: Dodaj odpowiednią objętość roztworu trypsyny/EDTA (zazwyczaj 0,5–1 ml na T-25). Upewnij się, że enzym pokrył całą powierzchnię.
- Inkubacja: Umieść butelkę w inkubatorze (37 °C, 5% CO2) na 2–5 minut.
- Uwaga: Niektóre delikatne linie komórkowe wymagają trypsynizacji w temperaturze pokojowej.
- Kontrola pod mikroskopem: Gdy komórki staną się zaokrąglone i zaczną „pływać” przy delikatnym puknięciu w ściankę butelki, proces jest zakończony.
- Zneutralizuje enzym: Dodaj pożywkę z dodatkiem FBS w odpowiedniej objętości (przynajmniej w stosunku 3:1). Białka zawarte w surowicy zahamują działanie enzymu. W przypadku hodowli bez dodatku surowicy użyj odpowiedniego inhibitora proteaz.
Postępowanie po trypsynizacji
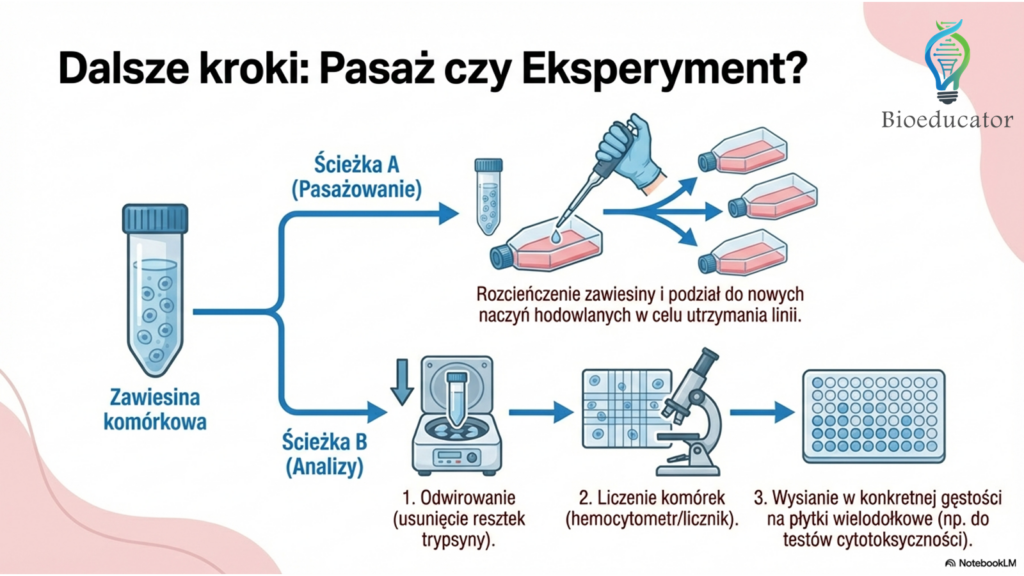
W zależności od celu w jakim komórki były odklejane zależy sposób dalszego postępowania.
Jeżeli celem trypsynizacji było przeniesienie komórek (pasaż) do nowych naczyń hodowlanych, wystarczy, że rozcieńczysz hodowlę i rozdzielisz ją do nowych butelek (zobacz: pasażowanie komórek).
Jeżeli twoim celem jest wysianie komórek na płytkach wielodołkowych w celu przeprowadzenia testów np. testów cytotoksyczności postępowanie będzie nieco dłuższe. W tym przypadku komórki trzeba będzie odwirować i policzyć (zobacz: metody liczenia komórek). Po policzeniu komórek można je zawiesić w docelowej gęstości i wysiać na płytki wielodołkowe.
Uwaga! Jeżeli w swoich eksperymentach badasz receptory zewnątrzkomórkowe, trypsyna może nie być odpowiedniem sposobem odklejania komórek. Inne sposoby odklejania komórek adherentnych znajdziesz w tym artykule.
Podsumowanie
Trypsynizacja to znacznie więcej niż „odklejanie” komórek. To precyzyjny zabieg biochemiczny, który polega na kontrolowanej degradacji białek adhezyjnych przy jednoczesnym zachowaniu integralności samej komórki. Kluczem do sukcesu jest:
- Dokładne usunięcie inhibitorów z surowicy (płukanie PBS).
- Zastosowanie EDTA w celu schelatowania jonów wapnia.
- Minimalizacja czasu ekspozycji na enzym.
Pamiętajcie, że każda linia komórkowa jest inna – fibroblasty mogą wymagać 10 minut w inkubatorze, podczas gdy komórki macierzyste mogą ulec uszkodzeniu już po 2 minutach. Zawsze optymalizujcie protokół pod swoje specyficzne warunki.
Bibliografia
