Chromatografia faz odwróconych (RP-HPLC, ang. Reversed-Phase High-Performance Liquid Chromatography) stanowi fundament współczesnej analityki chemicznej, odpowiadając za ponad 80% wszystkich rozdziałów realizowanych w laboratoriach R&D, kontroli jakości oraz diagnostyce klinicznej. Jej dominacja wynika z uniwersalności, stabilności faz stacjonarnych oraz doskonałej kompatybilności z detekcją masową (LC-MS).

Fizykochemiczny mechanizm retencji
W artykule „Podstawy chromatografii” wyjaśniliśmy już jaka jest różnica między chromatografią faz normalnych a odwróconych. Warto jednak do tego wrócić. Chodzi o układ faz (ruchomej i stacjonarnej). W chromatografii faz normalnych, faza stacjonarna jest polarna a faza ruchoma niepolarna (silne rozpuszczalniki organiczne). Jak nazwa skazuje, w przypadku faz odwróconych jest dokładnie na odwrót. Faza stacjonarna jest niepolarna (hydrofobowa) zaś ruchoma polarna.
Co ciekawe dziś to właśnie fazy odwrócone dominują. Jest tak dlatego, że ich zastosowanie jest dużo bardziej wszechstronne.
Mechanizm: Dlaczego substancje „uciekają” do kolumny?
Większość osób myśli, że kolumna (faza stacjonarna) działa jak magnes, który łapie cząsteczki. W rzeczywistości jest odwrotnie:
- Woda lubi wodę: Cząsteczki wody w płynie płynącym przez kolumnę (fazie ruchomej) są ze sobą bardzo mocno połączone (tworzą sieć wiązań wodorowych).
- Analit to intruz: Kiedy wstrzykujemy do układu badaną substancję (analit), która nie lubi wody, „rozpycha” ona te cząsteczki wody. Jest to dla układu bardzo męczące i niekorzystne energetycznie.
- Wypychanie: Woda chce jak najszybciej odzyskać swój spokój, więc dosłownie wypycha intruza w stronę „tłustych” łańcuchów, którymi wyłożona jest kolumna. Substancja chowa się tam, byle tylko mieć jak najmniejszy kontakt z wodą.
Trzy główne siły wewnątrz złoża
Kiedy nasza cząsteczka zostanie już wypchnięta z wody i trafi na hydrofobowe grupy fazy stacjonarnej, zaczynają działać trzy rodzaje oddziaływań:
1. Siły Londona (Najważniejsze)
To rodzaj „molekularnego kleju”. Występują między hydrofobowymi częściami cząsteczki a hydrofobowymi łańcuchami w kolumnie. Im bardziej cząsteczka jest „tłusta” (niepolarna), tym mocniej przykleja się do kolumny i tym wolniej z niej wypływa.
2. Oddziaływania Dipol-Dipol
Działają trochę jak małe magnesy. Jeśli substancja i kolumna mają specyficzne grupy chemiczne (np. fenylowe lub cyjanowe), mogą się nimi dodatkowo „złapać”.
3. Oddziaływania Elektrostatyczne (Często problematyczne)
To czysta elektryczność. Na powierzchni kolumny czasem zostają odsłonięte grupy kwasowe (np. grupy silanowe). Jeśli analit ma ładunek dodatni, „przylepi się” do nich zbyt mocno. Zazwyczaj chemicy starają się tego unikać, bo powoduje to ogonowanie pików.
W skrócie: Woda nie lubi niepolarnych analitów, więc spycha je na boczny tor (do kolumny). To, jak długo substancja tam zostanie, zależy od tego, jak bardzo lubi się z hydrofobowym wypełnieniem kolumny i jak sterujemy polarnością fazy ruchomej.
Charakterystyka faz stacjonarnych i budowa kolumn
Wybór odpowiedniej kolumny jest krytycznym etapem projektowania metody. Wydajność separacji zależy zarówno od chemii powierzchni, jak i fizycznej struktury nośnika.
Nośnik krzemionkowy i jego modyfikacje
Większość kolumn RP-HPLC bazuje na ultra-czystej krzemionce typu B (o niskiej zawartości metali). Kluczowe parametry to:
- Wielkość ziarna (dp): Standardowo 3–5 μmm dla HPLC, poniżej 2 μm dla UHPLC. Zmniejszenie średnicy ziarna drastycznie zwiększa sprawność kolumny (N), ale generuje wysokie ciśnienie wsteczne (zobacz również: wstęp do HPLC).
- Wielkość porów: Standardowe 60–120 Å dla małych cząsteczek. Dla białek i dużych peptydów stosuje się szerokoporową krzemionkę (300 Å), aby umożliwić swobodną dyfuzję makrocząsteczek do wnętrza porów.
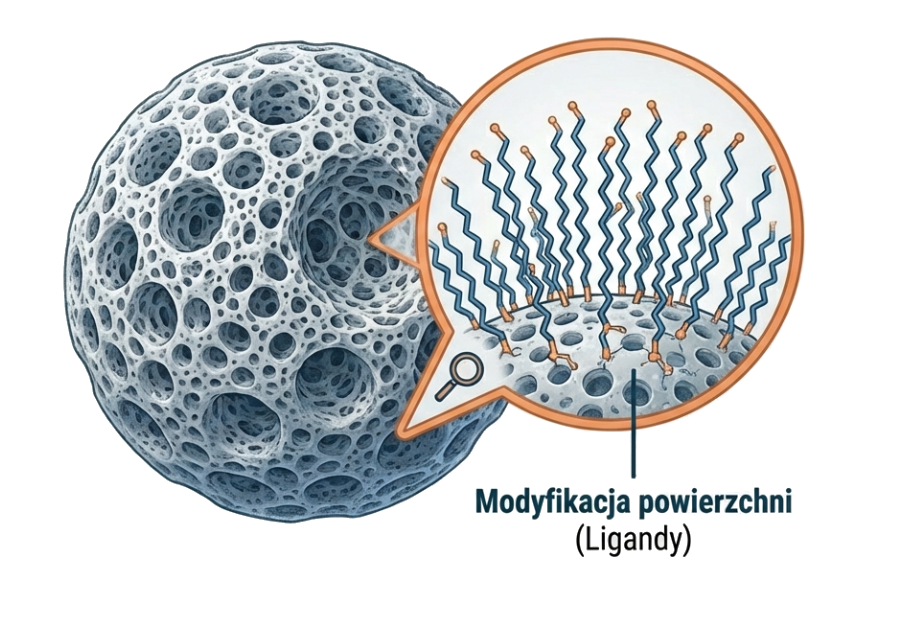
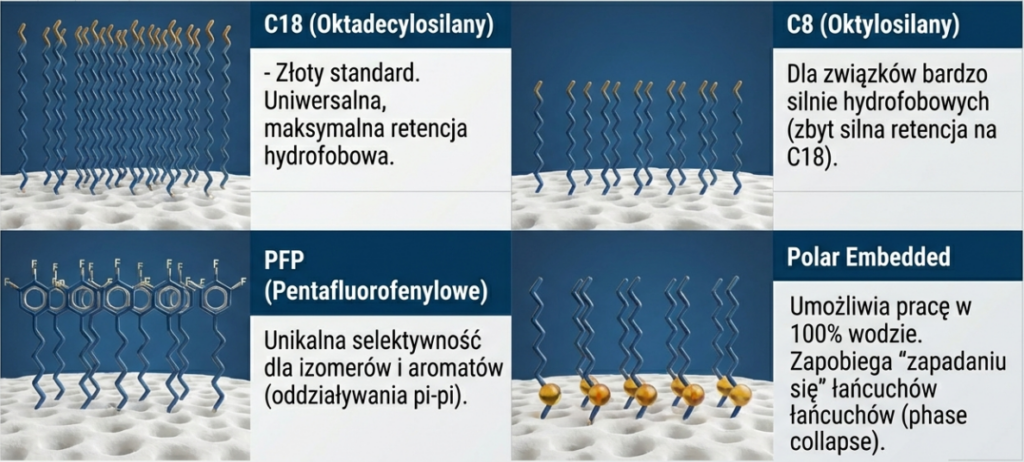
Rodzaje grup funkcyjnych
- C18 (Oktadecylosilany): Najbardziej uniwersalna faza, zapewniająca maksymalną retencję hydrofobową.
- C8 (Oktylosilany): Stosowane dla bardzo silnie hydrofobowych związków, gdzie retencja na C18 byłaby zbyt silna.
- PFP (Pentafluorofenylowe): Oferują unikalną selektywność dla izomerów i związków aromatycznych dzięki oddziaływaniom typu pi-pi oraz dipolarnym.
- Fazy typu „Polar Embedded”: Zawierają polarną grupę (np. amidową) wbudowaną w łańcuch alkilowy. Pozwalają na pracę w 100% fazie wodnej bez efektu „zapadania się” łańcuchów (ang. phase collapse).
End-capping: Dlaczego jest niezbędny?
Podczas modyfikacji krzemionki, ze względów sterycznych, nie wszystkie grupy silanolowe (-OH) ulegają związaniu z ligandem C18. Wolne silanole są kwasowe i mogą powodować ogonowanie pików (ang. peak tailing), szczególnie dla amin. End-capping to proces blokowania tych grup za pomocą małych cząsteczek, np. trimetylochlorosilanu (TMS), co znacząco poprawia symetrię pików i stabilność chemiczną kolumny.
Parametry optymalizacji rozdziału
Sukces w RP-HPLC zależy od precyzyjnego dostrojenia parametrów fazy ruchomej.
Skład fazy ruchomej
Polarnością fazy ruchomej można sterować. W tym celu najczęściej stosuje się modyfikatory organiczne: Acetonitryl (ACN) i metanol (MeOH). Ich dodatek do fazy ruchomej lub stopniowe zwiększanie stężenia (patrz. rozdział gradientowy) wpływa na zmianę czasu retencji hydrofobowych analitów.
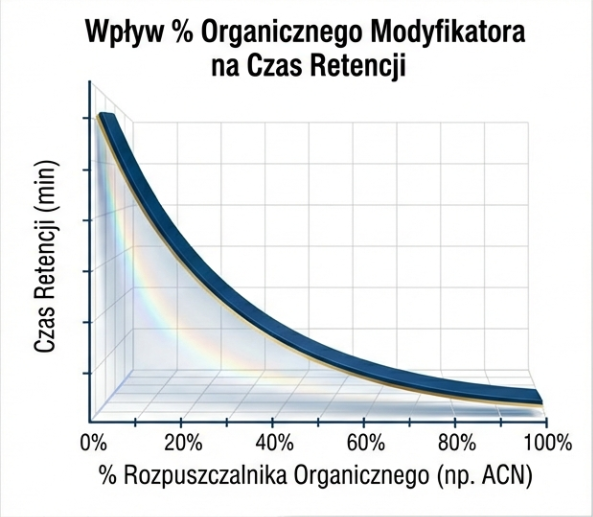
ACN charakteryzuje się niższą lepkością i wyższą mocą elucyjną niż MeOH. MeOH może oferować inną selektywność dzięki zdolności do tworzenia wiązań wodorowych. Wybór rozpuszczalnika jest jedną z rzeczy, które warto rozważyć przy wyborze metody analitycznej. Dla skomplikowanych matryc może to wpływać na ilość rozdzielanych pików a tym samym na możliwości wykrywania różnych substancji.
Współczynnik retencji
Współczynnik retencji w chromatografii cieczowej jest stosunkiem czasu jaki analit spędza w fazie stacjonarnej do czasu spędzonego w fazie ruchomej. Wyznaczany z czasu retencji i czasu objętości martwej.
Współczynnik retencji k’ opisujemy wzorem:
Gdzie tr to czas retencji analitu, a t0 to czas martwy. k’ powinno mieścić się w zakresie 1–10. Dla analizy ilościowej dobrze by wynosiło między 2 – 3.
Zbyt niska wartość k’ (<1) oznacza, że analit ma słabe wiązanie z kolumną. Zazwyczaj piki ogonują lub są słabo rozdzielone. W takim wypadku można spróbować zmniejszyć udział fazy organicznej na początku rozdziału, wypłaszczyć gradient lub przejść na rozdział izokratyczny. W skrajnych przypadkach można spróbować zastosować inną fazę stacjonarną lub inną technikę analityczną (np. HILIC).
Zbyt wysokie k’ (>10) wydłuża czas analizy a piki często ogonują. W tym przypadku może pomóc mocny gradient lub nawet izokratyczny rozdział w dużym stężeniu fazy organicznej. W skrajnych przypadkach może pomóc zmiana techniki separacji np. na HIC.
Rola pH i buforów
Kontrola pH jest kluczowa dla związków ulegających jonizacji.
- Kwasy: Przy niskim pH (pH < pKa) są w formie niezdysocjowanej (obojętnej), co drastycznie zwiększa ich retencję w RP-HPLC.
- Zasady: Przy wysokim pH (pH > pKa) stają się obojętne i lepiej się retardują.
Należy jednak pamiętać o ograniczeniach krzemionki: przy pH < 2 następuje hydroliza wiązań siloksanowych, a przy pH > 8 rozpuszczanie szkieletu krzemionkowego.
Uwaga! Współczesne kolumny hybrydowe mają wyższą tolerancję pH. Niekiedy mogą pracować w warunkach zasadowych sięgających nawet pH 12. Przed użyciem kolumny sprawdź zakres jej pracy.
Dodatki parujące jony (Ion-Pairing Agents)
Dla bardzo polarnych, zjonizowanych cząsteczek (np. małych peptydów), które słabo retardują, stosuje się dodatki takie jak kwas trifluorooctowy (TFA) lub kwas mrówkowy. TFA tworzy z analitem obojętną parę jonową, co zwiększa jego hydrofobowość i poprawia kształt piku. W LC-MS preferowany jest kwas mrówkowy ze względu na niższe tłumienie sygnału (ang. ion suppression).
Elucja izokratyczna vs. gradientowa
- Izokratyczna: Stały skład fazy ruchomej. Prostsza, nie wymaga czasu na kondycjonowanie kolumny, ale jest nieskuteczna przy próbkach o szerokim spektrum hydrofobowości.
- Gradientowa: Procentowy udział modyfikatora organicznego rośnie w czasie. Niezbędna w proteomice, przy analizie zanieczyszczeń farmaceutycznych i skomplikowanych próbek.
Analiza izokratyczna doskonale się sprawdza dla dość prostych prób. Elucja gradientowa świetnie się sprawdzi dla złożonych matryc oraz w przypadku, gdy w jednej próbce znajdują się związki o różnych stopniach polarności.
Uwaga! Jeśli prowadzisz analizę izokratyczną warto uwzględnić tzw. Gradient czyszczący. Polega on na zwiększeniu udziału fazy organicznej (niepolarnej) pod koniec metody by wypłukać pozostałości hydrofobowych zanieczyszczeń, które mogą pozostawać na kolumnie i przechodzić do kolejnych analiz.
Zalety i ograniczenia chromatografii faz odwróconych
Chromatografia faz odwróconych dominuje wśród współczesnych technik chromatografii cieczowej. Jest ona bardzo wszechstronna jednak jak każda ma swoje ograniczenia. Poniżej przedstawiamy zalety i ograniczenia RP-LC
| Zalety | Ograniczenia |
| Kompatybilność z MS: Większość faz ruchomych (ACN, woda, lotne bufory jak octan amonu) jest bezpośrednio wprowadzalna do spektrometru mas. Przewidywalność: Retencja koreluje z logP analitu (współczynnikiem podziału oktanol/woda). Stabilność: Kolumny RP są mechanicznie i chemicznie odporne przy zachowaniu odpowiednich procedur. | Związki silnie polarne: Cukry czy małe kwasy organiczne mogą eluować w czasie martwym (t0). Wymagają one technik HILIC lub wymiany jonowej. Stabilność pH: Standardowe kolumny mają wąskie okno pracy (pH 2–8). Rozwiązaniem są droższe kolumny hybrydowe (organiczno-nieorganiczne). |
Zastosowania praktyczne chromatografii faz odwróconych
Farmacja i Kontrola Jakości
RP-HPLC jest standardem USP/Ph. Eur. w testach czystości substancji czynnych (API). Pozwala na oddzielenie produktu głównego od produktów degradacji o niemal identycznej strukturze.
Biotechnologia: Analiza Białek i Peptydów
W procesach oczyszczania białek terapeutycznych, RP-HPLC służy do mapowania peptydowego (ang. peptide mapping). Po trawieniu białka trypsyną, otrzymany „odcisk palca” w gradiencie ACN pozwala potwierdzić poprawność sekwencji aminokwasowej oraz identyfikację modyfikacji posttranslacyjnych (PTM).
Kryminalistyka i Toksykologia
Badanie obecności ksenobiotyków w płynach ustrojowych. Dzięki wysokiej rozdzielczości RP-HPLC połączonej z MS/MS, możliwe jest jednoczesne wykrywanie setek narkotyków i ich metabolitów w jednej analizie.
Podsumowanie i wnioski
Chromatografia faz odwróconych to technika dojrzała, ale wciąż ewoluująca. Zrozumienie, że retencja jest procesem dynamicznym, zależnym od delikatnej równowagi między hydrofobowością analitu a składem fazy ruchomej i chemią powierzchni, pozwala na świadome projektowanie metod.
W dobie UHPLC i szybkich rozdziałów, szczególne znaczenie zyskuje optymalizacja temperatury (zmniejszenie lepkości fazy) oraz czystość odczynników, co bezpośrednio przekłada się na czułość i powtarzalność wyników w skali R&D.
Literatura
- https://chem.libretexts.org/Bookshelves/Analytical_Chemistry/Supplemental_Modules_(Analytical_Chemistry)/Instrumentation_and_Analysis/Chromatography/Chromatographic_Columns
- Horváth, C., Melander, W., & Molnár, I. (1976). Solvophobic interactions in liquid chromatography with nonpolar stationary phases. Journal of Chromatography A, 125(1), 129-156.
- United States Pharmacopeia (USP). General Chapter <621> Chromatography.
- Waters Corporation (2023). Beginner’s Guide to HPLC & RP-HPLC Technology. Technical Note.
- Agilent Technologies (2022). High Performance Liquid Chromatography: Method Development Guide. Application Compendium.
