Chromatografia cienkowarstwowa, znana jako TLC (z ang. Thin-Layer Chromatography), to jedna z fundamentalnych i najczęściej stosowanych technik analitycznych w chemii i biologii. Dzięki swojej prostocie, szybkości i niskiemu kosztowi, stanowi nieocenione narzędzie w laboratoriach na całym świecie. Pozwala na szybkie rozdzielanie, identyfikację oraz wstępną analizę ilościową składników złożonych mieszanin.

Co to jest chromatografia?
Chromatografia to technika rozdziału mieszanin, w której substancje transportowane przez ruchomą fazę (faza mobilna) przechodzą przez fazę stacjonarną. W wyniku różnic w oddziaływaniach pomiędzy substancjami a fazą stacjonarną dochodzi do rozdziału tych substancji. Więcej o podstawach chromatografii znajdziesz tutaj.
Co to jest chromatografia cienkowarstwowa?
Chromatografia cienkowarstwowa to technika chromatografii planarnej, która służy do rozdzielania składników mieszaniny. Proces ten odbywa się na płytce pokrytej cienką warstwą materiału adsorpcyjnego, zwanego fazą stacjonarną. Mieszanina, naniesiona w postaci niewielkiej kropki lub kreski na płytkę, jest rozwijana przez roztwór rozpuszczalnika, zwanego fazą ruchomą lub eluentem. Eluent przemieszcza się w górę płytki dzięki siłomkapilarnym. W miarę jak faza ruchoma przemieszcza się w górę płytki, poszczególne składniki mieszaniny wędrują z różną prędkością, co prowadzi do ich rozdzielenia. Taki układ eksperymentalny nazywamy chromatografią wstępującą (od wstępującej fazy ruchomej).
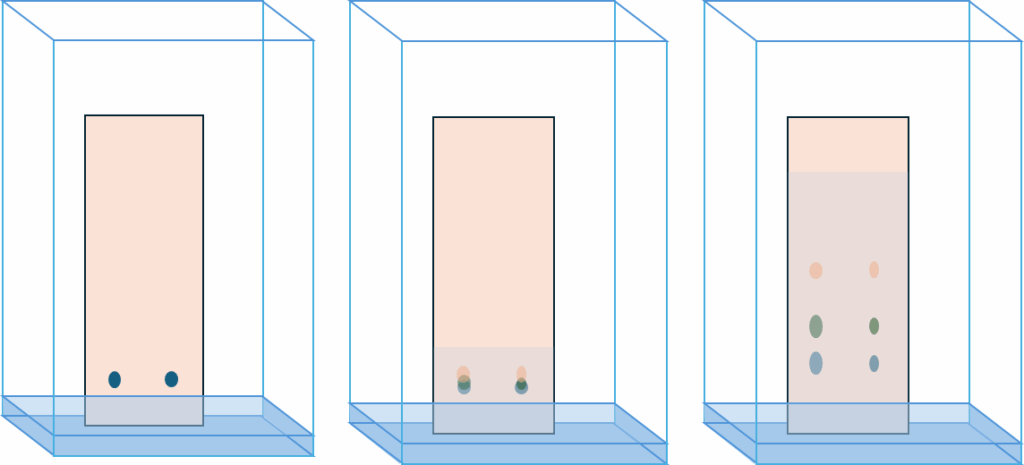
W chromatografii cienowarstwowej wykorzystywane są również dwa inne sposoby rozdziału:
- Chromatografia zstępująca: fazę ruchoma znajduje się w wanience znajdującej się w górze komory. Doprowada się do dołu dzięki paskowi bibuły
- Chromatografia pozioma – wymaga specjalnej komory. Faza ruchoma znajduje się w rynience w jednej częsci komory i przy pomocy bibuły przechodzi do drugiej rynienki. Chromatografia pozioma nadaje się do rozdziału wolno migrujących cząsteczek o podobnej strukturze. Zapewnia dużą rozdzielczość.
Mechanizm rozdziału w chromatografii cienkowarstwowej
Podstawą rozdziału w chromatografii cienkowarstwowej jest zróżnicowane oddziaływanie pomiędzy analitem, fazą ruchomą i stacjonarną. Dwa główne mechanizmy, które za to odpowiadają, to adsorpcja i podział. Z tego powodu chromatografię cienkowarstwową dzielimy na:
- Chromatografia adsorpcyjna (najczęstsza w TLC): Faza stacjonarna (np. żel krzemionkowy) jest bardziej polarna niż faza ruchoma (zwykle mieszanina rozpuszczalników organicznych). Polarne składniki mieszaniny silniej oddziałują (adsorbują się) z polarną fazą stacjonarną i wędrują wolniej. Mniej polarne składniki są słabiej zatrzymywane i przemieszczają się szybciej wraz z fazą ruchomą.
- Chromatografia podziałowa: W tym przypadku na nośniku (fazie stacjonarnej) osadzona jest ciecz (np. woda). Rozdział następuje na podstawie różnic w rozpuszczalności analitów pomiędzy stacjonarną warstwą cieczy a fazą ruchomą.
W praktyce, ostateczny rozdział jest wynikiem złożonych oddziaływań, w tym sił van der Waalsa, wiązań wodorowych i oddziaływań dipol-dipol.
Rodzaje faz stacjonarnych w chromatografii cienkowarstwowej
Wybór odpowiedniej fazy stacjonarnej jest kluczowy dla skutecznego rozdziału. Najpopularniejsze z nich to:
- Żel krzemionkowy: Najczęściej stosowana faza stacjonarna. Ma charakter kwasowy i jest silnie polarna dzięki obecności grup silanolowych (-Si-OH). Idealna do rozdzielania związków o zróżnicowanej polarności, takich jak aminokwasy, alkaloidy czy cukry.
- Tlenek glinu: Ma charakter od lekko zasadowego do obojętnego. Jest używany do rozdzielania związków zasadowych, takich jak aminy, oraz do separacji związków obojętnych, np. węglowodorów czy steroidów.
- Celuloza: Polimer glukozy o polarnej naturze. Umożliwia rozdział w mechanizmie podziałowym, gdzie fazą stacjonarną jest woda związana z włóknami celulozy. Doskonała do analizy związków hydrofilowych, np. aminokwasów i nukleotydów.
- Fazy z modyfikowaną powierzchnią (fazy odwrócone, RP): Są to fazy, w których polarne grupy żelu krzemionkowego zostały chemicznie zmodyfikowane przez przyłączenie niepolarnych łańcuchów węglowodorowych (np. C8, C18). W tym układzie faza stacjonarna jest niepolarna, a faza ruchoma jest polarna (np. mieszaniny wody z metanolem lub acetonitrylem). Mechanizm ten nazywa się chromatografią w układzie faz odwróconych (RP-TLC).
Poniżej przedstawiamy przykłady zastosowania różnych faz stacjonarnych:
| Adsorbent | Mechanizm rozdziału | Przykłady związków |
|---|---|---|
| Żel krzemionkowoy | adsorpcja, podział | niemal wszystkie |
| Tlenek glinu | adsorpcja, podział | zasady i steroidy |
| Ziemia krzemionkowa | podział | cukrowce, wyższe kwasy tłusczowe |
| Fosforan magnezowy, krzemian magnezowy, wodorotlenek wapnia, fosforan wapniowy | adsorpcja | karetonoidy i tokoferole |
| Węgiel | adsorpcja | związki niepolarne |
| Wymieniacze jonowe | wymiana | kwasy nukleinowe |
Jak dobrać fazę ruchomą?
Dobór fazy ruchomej (eluentu) jest procesem optymalizacji, który ma na celu uzyskanie jak najlepszego rozdziału (różnic w prędkości migracji) analitów. Kluczowe zasady to:
- Reguła „podobne rozpuszcza podobne” jest tu odwrócona: Aby substancja przemieszczała się po płytce, faza ruchoma musi mieć zdolność „wypłukiwania” jej z fazy stacjonarnej.
- Polarność eluentu: Siła elucyjna rozpuszczalnika (jego zdolność do przesuwania analitów w górę płytki) zależy od jego polarności.
- W przypadku faz normalnych (np. żel krzemionkowy), im bardziej polarny eluent, tym silniej oddziałuje on z fazą stacjonarną, konkurując z analitami o miejsca aktywne i tym samym przyspieszając ich migrację.
- W przypadku faz odwróconych, im mniej polarny eluent, tym większa jego siła elucyjna.
- Szereg eluotropowy: W chromatografii cienkowarstwowej niemożliwe jest wykonanie rozdziału gradientowego (jak np. w HPLC). Można natomiast wykorzystać tzw. Szereg eluotropowy. Krótko mówiąc wykorzystuje się kolejno rozpuszalniki o rosnącej sile elucyjnej. Przykładowy szereg (od najsłabszego do najsilniejszego eluentu): heksan < toluen < chloroform < octan etylu < aceton < etanol < metanol.
- Mieszaniny rozpuszczalników: Rzadko używa się pojedynczego rozpuszczalnika. Najczęściej stosuje się mieszaniny, np. heksanu z octanem etylu. Zmieniając proporcje składników, można precyzyjnie „dostroić” polarność eluentu i uzyskać optymalne wartości współczynnika Rf (patrz niżej).
Wybarwianie chromatogramu TLC i detekcja
Jeśli rozdzielone substancje są barwne, można je zaobserwować gołym okiem. Zazwyczaj są one jednak bezbarwne i wymagają specjalnych metod detekcji:
- Światło UV: Wiele płytek TLC zawiera wskaźnik fluorescencyjny, który emituje zielone światło pod wpływem promieniowania UV o długości fali 254 nm. Związki, które absorbują promieniowanie UV, gaszą tę fluorescencję i pojawiają się jako ciemne plamy. Inne związki mogą same fluoryzować.
- Pary jodu: Płytkę umieszcza się w komorze nasyconej parami jodu. Jod ulega adsorpcji na powierzchni analitów (szczególnie związków organicznych), co prowadzi do pojawienia się żółtych lub brązowych plam. Jest to metoda uniwersalna i zazwyczaj odwracalna.
- Odczynniki wywołujące (spryskiwacze): Są to roztwory chemiczne, którymi spryskuje się płytkę. Reagują one ze specyficznymi grupami funkcyjnymi analitów, dając barwne produkty. Oto przykłady niektórych odczynników wybarwiających
- Ninhydryna: do detekcji aminokwasów (daje fioletowe plamy).
- Nadmanganian potasu (KMnO_4): do detekcji związków łatwo utleniających się, np. związków nienasyconych (pojawiają się żółte plamy na fioletowym tle).
- Roztwór waniliny w kwasie siarkowym: uniwersalny wywoływacz do wielu związków organicznych, daje szeroką gamę barw po podgrzaniu płytki.
Sposób obliczeń
Wybarwienie chromatogramu, uwidocznienie plamek to dopiero początek analizy wyników. Każda plamka to jedna z rozdzielonych substancji. Trzeba je jeszcze zidentyfikować. Podstawowym parametrem, który pomaga w identyfikacji substancji jest współczynnik opóźnienia (Rf)
Jak wyznaczyć Rf (Współczynnik opóźnienia)?
Współczynnik opóźnienia (Rf, Retardation factor) to podstawowy parametr w chromatografii planarnej, opisujący pozycję plamki na chromatogramie. Jest to stosunek drogi przebytej przez substancję do drogi przebytej przez czoło eluentu.
Rf= a/b
Gdzie:
- a – odległość od linii startu do środka plamki analitu.
- b – odległość od linii startu do linii czoła fazy ruchomej.
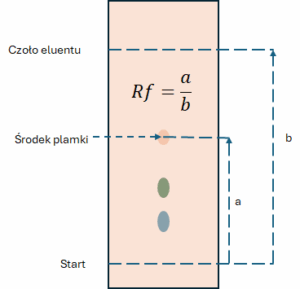
Wartość Rf jest zawsze mniejsza od 1. W idealnych warunkach jest ona stała dla danego związku, fazy stacjonarnej i ruchomej, co pozwala na wstępną identyfikację substancji poprzez porównanie z wzorcem.
Densytometria
Densytometria to technika instrumentalna, która przekształca TLC z metody jakościowej w ilościową. Polega na pomiarze ilości światła odbitego lub przepuszczonego przez plamkę na chromatogramie za pomocą specjalnego skanera (densytometru). W przypadku barwnych substancji lub zastosowania odczynników wywołujących można wykorzystać zwykły skaner lub nawet aparat. Obróbkę obrazu i obliczenia wykonuje specjalny program komputerowy. Intensywność sygnału (powierzchnia piku) jest proporcjonalna do stężenia substancji w plamce. Pozwala to na oznaczenie ilościowe poszczególnych składników w badanej próbce na podobnej zasadzie jak w przypadku HPLC.
Zastosowanie – przykłady
Wszechstronność TLC sprawia, że jest ona stosowana w wielu dziedzinach:
- Farmacja i medycyna:
- Kontrola czystości substancji czynnych i produktów leczniczych.
- Monitorowanie przebiegu syntezy organicznej.
- Diagnostyka kliniczna, np. badanie obecności leków lub narkotyków w płynach ustrojowych (krwi, moczu).
- Przemysł spożywczy:
- Wykrywanie pestycydów i konserwantów.
- Analiza barwników spożywczych (naturalnych i syntetycznych).
- Identyfikacja mykotoksyn (np. aflatoksyn) w żywności.
- Ochrona środowiska:
- Analiza zanieczyszczeń w wodzie i glebie (np. wielopierścieniowych węglowodorów aromatycznych – WWA).
- Kosmetologia:
- Identyfikacja i kontrola czystości składników kosmetyków, np. konserwantów czy filtrów UV.
- Kryminalistyka:
- Analiza śladów (np. atramentu z dokumentów, barwników z włókien).
- Badanie zawartości narkotyków (np. THC w próbkach narkotyków, roślin itp.)
Podsumowanie
Chromatografia cienkowarstwowa to potężna, szybka i tania technika analityczna, która mimo rozwoju bardziej zaawansowanych metod, wciąż pozostaje niezastąpiona w wielu laboratoriach. Jej prostota wykonania, możliwość jednoczesnej analizy wielu próbek oraz łatwość wizualizacji wyników sprawiają, że jest doskonałym narzędziem zarówno do celów badawczych, jak i edukacyjnych. Od monitorowania reakcji chemicznej po analizę kliniczną – TLC udowadnia, że czasem najprostsze rozwiązania są najbardziej eleganckie.
Źródła
- Kłyszejko – Stefanowicz L. (2003). Ćwiczenia z biochemii. PWN
- Wall, P. E. (2005). Thin-layer Chromatography: A Modern Practical Approach. Royal Society of Chemistry.
- Spangenberg, B., Poole, C. F., & Weins, C. (Eds.). (2011). Quantitative Thin-Layer Chromatography: A Practical Survey. Springer.
- https://chem.libretexts.org/Bookshelves/Analytical_Chemistry/Supplemental_Modules_(Analytical_Chemistry)/Instrumental_Analysis/Chromatography/Thin_Layer_Chromatography
- Cygański, A. (2018). Metody Spektroskopowe w Chemii Analitycznej. Wydawnictwo WNT. (Książka ta często zawiera rozdziały o metodach separacyjnych jako technikach pomocniczych).
- Witkiewicz, Z. (2000). Podstawy chromatografii. Wydawnictwo WNT.
